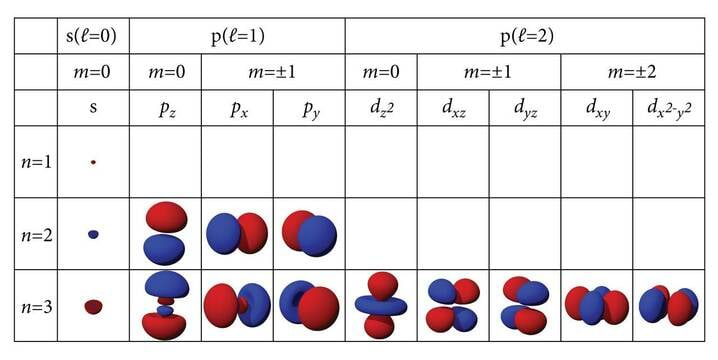
Perioodtabeli koostamise aegu järjestati elemendid aatommasside järgi ja nii said nad endale järjenumbrid. Tegelikult kajastab järje- ehk aatomnumber (Z) elektronide arvu aatomis ja ühtlasi tuuma elementaarlaengute arvu. Elektronkatte kihiline ehitus võimaldab kaugemates kihtides hoida rohkem elektrone. Esimese (tuumale lähema, alumise, kõige sügavama, väiksema energiaga) kihi peakvantarv on üks () ja sinna mahub kaks elektroni. Arvestades ka spinni mahub igasse kihti elektroni. Esimeses perioodis ongi kaks elementi, sellega on esimene kiht täis ja täituma hakkab teine. Teise kihi peakvantarv on 2, sinna mahub 8 elektroni. Aatomite keemilisi omadusi määravad väliselektronid. Heeliumil ja neoonil on väliskihid elektrone täis ja nende keemilised omadused on väga sarnased. Pole uudiseks, et kui väliselektrone on vähe, on need nõrgalt seotud ja aatomid kalduvad neid loovutama. Kui aga väliskiht on peaaegu täitunud, täituvad allesjäänud kohad kergesti teistelt aatomitelt saadaolevate elektronidega. Väliselektronid on sidemete moodustumise alus. Keemiliselt kõige põnevamad on nelja väliselektroniga aatomid, nagu süsinik ja räni, mis oma nelja võimaliku sidemega pakuvad võimaluse lõputu arvu ühendite tekkimiseks. Paljude elektronidega aatomites muutub üha olulisemaks elektronide omavaheline mõju ja alates neljandast perioodist läheb kihtide järjestikuse täitumise reegel segamini. Neljandasse kihti läheb esimene elektron enne, kui kolmandas on kõik võimalikud kohad hõivatud.
| Joonis 2.2.7. Elektronide tõenäosuslikku paigutust aatomi sees on võimalik välja arvutada ja katseliselt kinnitada. Kas on võimalik ka tõeliselt elektronkattesse piiluda või vähemalt otse aatomite seest pärinevaid andmeid pildiks muuta? 2013. aastal avaldas rahvusvaheline teadlaste rühm pildid, kus väidetavalt esimest korda paistab ergastatud vesiniku aatomi elektronstruktuur. Kasutatud on uut „kvantmikroskoopi”, kus toimib juba 30 aastat tagasi välja pakutud fotoionisatsioonmikroskoopia meetod. Laseriga ioniseeritavast aatomist erinevates suundades väljuvad elektronid suunatakse elektrivälja abil läbi elektrostaatilise läätse ekraanile. Tekkinud elektronlainete interferentsipilt kannab otsest infot elektronide leiulainetest. | Kass riputab üles perioodilisustabeli |