Teame, et kõik aatomid koosnevad prootonitest, neutronitest ja elektronidest. Aatomituum koosneb prootonitest ja neutronitest, aatomituuma moodustavaid osakesi nimetatakse kokku ka nukleonideks.
Kuidas kajastub aatomite tuuma ehitus perioodilisustabelis?
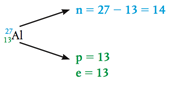
Erinevate elementide aatomid erinevad üksteisest prootonite arvu poolest. Prootonite arvu aatomituumas näitab aatomnumber.
Aatomnumbrit nimetatakse ka elemendi järjekorranumbriks ehk laenguarvuks ning tähistatakse tähega Z. Ühe ja sama elemendi aatomitel on alati sama aatomnumber.
Kuna aatom tervikuna on neutraalne, siis peab elektronide arv aatomis olema võrdne prootonite arvuga.
Aatomi massi kirjeldab selle massiarv. Massiarvu määravad ära prootonite ja neutronite arv. Kuna elektroni mass on väga väike, siis seda aatomi massi arvutamisel ei arvestada. Massiarvu tähis on A.
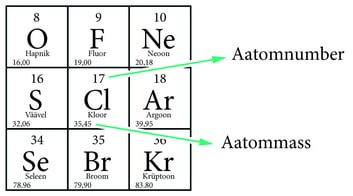
Perioodilisustabelist näeme, et kloori aatomnumber on 17, mis tähendab seda, et kloori aatomi tuumas on 17 prootonit. Kloori aatommassiks perioodilisustabelis on märgitud 35,45.
Aatommassi kohta oleme keemias õppinud, et see on ühe aatomi mass aatommassiühikutes ja ligikaudu võrdne massiarvuga. Arvutustes kasutasime ümardatud aatommassi ja see näitab prootonite ja neutronite arvu.
Kuidas on võimalik, et aatommass ei ole täisarv? Ei ole ju võimalik, et meil on klooris 17 prootonit ning 35,45 –17 = 18,45 neutronit!
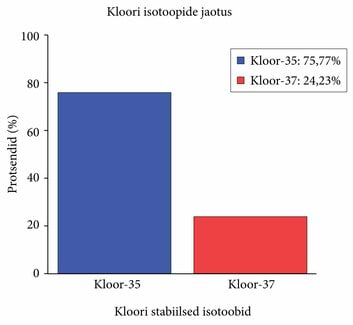
Samal elemendil on olemas erineva aatommassiga aatomeid. Klooril on olemas aatomid, milles on 17 prootonit ning 18 neutronit, seega aatommass on 35 (35Cl) ning samas esineb ka aatomeid, milles on 17 prootonit ning 20 neutronit, ehk aatommass on 37 (37Cl).
Aatomeid, milles on sama arv prootoneid, kuid erinev arv neutroneid, nimetatakse isotoopideks.
Keemilise elemendi aatommass on selle elemendi looduses esinevate isotoopide aatommasside kaalutud keskmine. Kaalutud keskmine tähendab siin seda, et kui näiteks kloor-35 isotoopi esineks looduses täpselt kolm korda rohkem, kui kloor-37 isotoopi, siis võetaks seda keskmistamisel arvesse kolmekordselt:
Kasutades täpsemaid arve saame
Ühe elemendi kõigil isotoopidel on samad keemilised omadused, kuna keemilised omadused ei ole seotud neutronite arvuga.