Kõik me oleme kunagi oodanud, et vesi kannus keema läheks. Teame, et temperatuuri tõusuga kaasneb kõigepealt kiirem aurustumine, molekulid hakkavad veepinnalt üha rohkem lahkuma. Muidugi aurustub veidike ka külm vesi – kuna molekulide soojusliikumise kiirused on erinevad, siis leidub alati osakesi, millel on juhuslikult piisavalt liikumisenergiat, et pinnakihist välja pääseda. Vee all, pinnast kaugemal võib samuti olla lahkumiseks piisavalt kiireid molekule. Kui neid on vähe, siis nad välja ei pääse, sest kaotavad aeglasemate molekulidega põrkudes kiiruse.
Aurustumisel pöördub osa molekule pidevalt õhust vette tagasi. Selle tulemusena on veepinna kohal õhk püsivalt niiske, st sisaldab veidi veeauru (ptk Õhuniiskus). Temperatuuri tõusuga saavad vee molekulid hoogu juurde ja hakkavad üha enam veepinnalt lahkuma. Kuid see pole veel keemine. Keemistemperatuuril on kiireid molekule juba nii palju, et intensiivne aurustumine algab kogu vedelikus, mitte ainult pinnal. Tekivad aurumullid, mis kiiresti pinnale tõusevad, vesi on keema läinud. Kuni vett kannus veel on, temperatuur ei tõuse, selles mõttes on keemine sarnane sulamisega (ptk Molekulid. Tahkis).
Mõnikord, kui puhast vett kuumutatakse väga ühtlaselt, ilma segamata (näiteks mikrolaineahjus), võib temperatuur tõusta veidi üle keemistemperatuuri ilma aurumullide tekkimiseta. Kui sellist ülekuumutatud vedelikku veidi liigutada, algab keemine väga äkki. Pliidil ülekuumutatud vett teha ei saa, sest alt soojendamine põhjustab konvektsiooni, segab vett pidevalt ja mullid hakkavad tasapisi tekkima nõu kuumal põhjal.
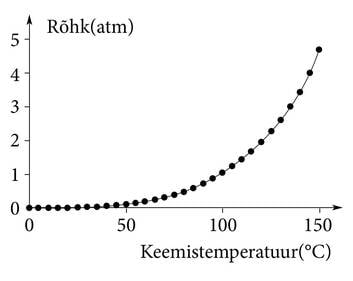
Vee keemistemperatuur valiti juba väga ammu meie igapäevaselt kasutatava praktilise temperatuuriskaala (Celsiuse skaala) üheks aluseks, kindlaks punktiks. Arvatavasti just seepärast teavad kõik, et vesi keeb 100°C juures. Tegelikult sõltub vee keemistemperatuur üsna palju välisrõhust. Keemisel tekivad mullid saavad „ennast täis puhuda” ainult siis, kui aururõhk ületab välisrõhu. Teekannus on väliseks veele mõjuvaks rõhuks õhurõhk. See on küll veidi muutuv, aga igapäevasel teekeetmisel ei pruugi keemistemperatuuri muutuse pärast muretseda.
Mägedes, kus õhurõhk on oluliselt väiksem, tuleb toiduvalmistamisel arvestada, et vesi keeb madalamal temperatuuril. 6000-meetristele mägedele tõustes peavad alpinistid laagris toitu valmistades arvestama umbes 80°C juures keeva veega. Tõsiasja, et puhta vee keemistemperatuur lahtises anumas on otseselt seotud õhurõhuga ning selle kaudu ka päris rahuldavalt kõrgusega merepinnast (ja ka sügavusega allpool merepinda), kasutasid vanasti maadeavastajad ja loodusuurijad kõrguse määramiseks.
| Joonis 1.2.2. Keedunõus kaitseventiiliga kõrgendatud rõhku hoides on võimalik keeta vett kõrgemal temperatuuril kui 100°C. Survemahutis (autoklaavis) kaheatmosfäärilise rõhu all keeb vesi umbes 120°C juures. Sellist kõrgel rõhul ja temperatuuril keetmist kasutatakse steriliseerimiseks ja materjalide töötlemiseks. |
Keemistemperatuur. Siiani on jutuks olnud ainult vee keemine. Sobivatel tingimustel keevad ja moodustavad seejuures auru kõik ained, kui nad just kuumutamisel ei lagune. Keemistemperatuur ja selle sõltuvus rõhust on aine olulised füüsikalised omadused. Keemistemperatuuri atmosfäärirõhul on lihtne määrata. Seda muidugi juhul, kui aine üldse atmosfäärirõhul vedelas olekus esineb (ptk Molekulid. Tahkis). Kui vedelik keeb, st aurumullid tekivad ühtlaselt kogu nõus ja termomeeter näitab püsivalt ühte temperatuuri, siis ongi tegemist keemistemperatuuriga. Sulamistemperatuuri määramine on selles mõttes keerulisem, et alati peab kasutama hästi väikest ainekogust (ptk Molekulid. Tahkis).
Segude ja lahuste keemisel on olukord keerulisem. Lahuste keemistemperatuur on kõrgem kui puhtal lahustil. Selle põhjuseks on, et paljud lahustunud ained ei osale aurustumisel, ei lähe üle gaasilisse faasi (aurumullidesse). Lendumatu lahustunud aine aururõhku ei tekita. Keemiseks vajaliku välisrõhuga võrdse aururõhu saavutamiseks tuleb lahust kuumutada veidi kõrgemale temperatuurile. Lahuste keemistemperatuuri erinevus lahustite omast on huvitav nähtus. On selgunud, et keemistemperatuuri muutus sõltub ainult lahustunud osakeste kontsentratsioonist. Ei ole oluline, milline aine on lahustunud ja kas osakesed on ioonid, aatomid või molekulid.
Leidub päris palju kokandusnõuandeid, kus soovitatakse kindlasti lisada soola keeduvette, mitte hiljem valmistoidule. Väidetavalt tõstab soola lisamine keemistemperatuuri nii palju, et makaronid keevad kiiremini pehmeks. Jätame maitse-eelistused kõrvale ja küsime, kas keemistemperatuuri tõusust võib oodatud kasu olla?
Lahuste keemistemperatuuri tõus () sõltub lahuse molaalsusest (), lahusti omadusi kirjeldavast ebullioskoopilisest konstandist () ja isotoonilisest kordajast ().
Kui keeduveele lisada ühe liitri kohta 2 teelusikatäit soola (12 g), siis on saadud lahuse molaalsus 0,2 mol/kg. Vee ebullioskoopiline konstant on 0,512 K·kg·mol-1. Isotooniline kordaja kirjeldab aine lahustumisel tekkivate ioonide arvu, keedusoola korral .
Soola lisamisest saadav keemistemperatuuri tõus on tühine, toidu valmimise kiirust see ei mõjuta. Samas on muidugi võimalik, et mingid muud kaalutlused, maitse-eelistused, traditsioonid vms põhjendavad keedusoola koguse ja lisamise aja.
Lahustunud aineks on siin keedusool, mille sulamistemperatuur on 801°C ja keemistemperatuur 1413°C. Kuna vesi ja ka soolvesi keevad palju madalamal temperatuuril, kui keedusool sulab, siis võib öelda, et lahustatud on tahke aine. Täpsemalt, lahustunud aine oleks lahuse keemise temperatuuril tahke. See ei pruugi alati nii olla, näiteks vedelikud võivad lahustuda üksteises ja gaasid võivad lahustuda vedelikes. Isegi tahkes aines võib lahustuda gaas või vedelik.