Keemiliselt puhas vesi on dielektrik (isolaator). Ohutustehnika juhib tähelepanu ohtudele elektriseadmete kasutamisel vesistes ja niisketes kohtades. Hoiatus on õigustatud, kuna vesi, lahustades aineid, tekitab ioone. Juba väike lahustatava aine kogus () muudab puhta vee elektrijuhiks. Elektrolüüt on aine, milles laengukandjateks on ioonid.
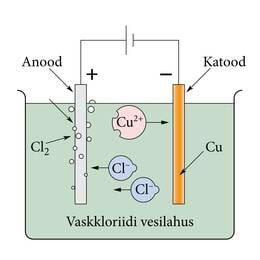
Kui näiteks vaskkloriidi lahustada vees, siis veemolekulide toimel laguneb sool ioonideks . Sellist protsessi nimetatakse elektrolüütiliseks dissotsiatsiooniks ja tekkinud lahus on elektrolüüt. Paneme lahusesse elektroodid, näiteks söepulgad. Katoodiks nimetatud elektrood on ühendatud vooluallika miinusklemmiga ja anood plussklemmiga (joonis 1.8.).
Vooluallika tekitatud elektriväli paneb ioonid lahuses triivima elektroodide poole. Positiivselt laetud vase ioonid liiguvad katoodile, saavad puuduvad elektronid ja vask sadestub katoodile. Negatiivselt laetud kloori ioonid liiguvad anoodile, annavad seal ära liigse elektroni ja eralduvad gaasilise kloorina. Selliseid elektrivoolu toimel kulgevaid redoksreaktsioone nimetatakse elektrolüüsiks. Elektrivool elektrolüütides on ioonide suunatud liikumine. Vooluga elektrolüütides kaasneb ainete eraldumine elektroodidel. Esimesena võeti elektrolüüs kasutusele esemete katmisel kulla- või hõbedakihiga. Elektrolüüsi seaduse avastas Michael Faraday. Elektrolüüsil eraldunud aine mass on võrdeline elektrolüüti läbinud laenguga, kus võrdetegurit nimetatakse aine elektrokeemiliseks ekvivalendiks.
Katsest saadud vase elektrokeemiline ekvivalent on . See tähendab, et eelnevalt kirjeldatud katses eraldub iga elektrolüüti läbinud laengu kohta katoodile vaske.
Ka metallimaagi või soola sulatamisel tekivad ioonid ja seda asjaolu saab kasutada näiteks alumiiniumi elektrolüütiliseks tootmiseks boksiidist või naatriumi saamiseks keedusoolast. Alati ei ole elektrolüüsil toimuvad protsessid nii lihtsad kui eespool kirjeldatud. Sõltuvalt metalli aktiivsusest ja elektroodide materjalist võivad eralduda erinevad ained. Näiteks sulatatud elektrolüüsil eralduvad naatrium ja kloor, kuid vesilahuse elektrolüüsil eralduvad hoopis vesinik ja kloor.