Kui paneme vee sügavkülma, see mõne aja pärast jäätub. Kui võtame tekkinud jää sealt välja ja hoiame seda käes, siis tunneme, et käsi muutub külmaks ning tahke jää muutub osaliselt veeks.
Need protsessid on meile hästi tuttavad. Protsessi, kus tahke aine muutub vedelaks, nimetatakse sulamiseks. Vedela aine muutumist tahkeks aineks nimetatakse tahkumiseks.
Kuidas liigub energia nendes protsessides?
Meie käsi tunneb külma, kui see jahtub, ning jahtub siis, kui annab osa oma aineosakeste soojusliikumise energiast, s.o siseenergiast ära. Jää sulamisel tunneme külma. Sellest saame järeldada, et jää sulamiseks on vaja energiat, mis alati võetakse soojusvahetuse kaudu ümbritsevatelt kehadelt.
Kuidas vee tahkumist uurida? Selleks saab hästi kasutada jäävett, mida suvel palava ilmaga on mõnus juua. Kas oled kunagi mõõtnud jäävee temperatuuri?
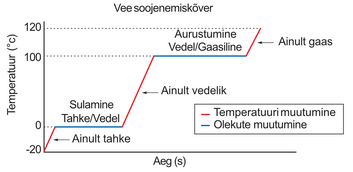
Valame klaasi toasooja vett, lisame sinna sisse jääkuubikuid ja mõõdame siis vee temperatuuri. Temperatuur hakkab langema ning mõne aja pärast on see 0 ºC ning enam allapoole ei lange. Järelikult on meil saavutatud soojuslik tasakaal jäätükkide ja vee vahel – mõlema temperatuur on 0 ºC.
Mis juhtub kui lisada 0 ºC jäävette –20 ºC jääkuubik? Kas jäävee temperatuur langeb nüüd alla 0 ºC? Katseliselt veendume, et ükskõik, kui palju ja kui külma jääd me vette ei paneks, jäävee temperatuur on ikka 0 ºC. Samas aga hakkab lisatud jää temperatuur tõusma. Teame, et keha temperatuuri tõstmiseks on vaja energiat. Kust see energia võetakse?
Märkame, et kui lisame 0 ºC jäävette –20 ºC jääd, siis osa vett jäätub. Vesi jäätub seetõttu, et jää temperatuur hakkab tõusma ning temperatuuri tõusmiseks vajalik soojushulk saadakse vee jäätumisel ehk tahkumisel.
Aine sulamiseks on vaja energiat. Tahkumise käigus energiat alati eraldub.
Katsest saame järeldada veel seda, et sulamine/tahkumine toimub ühel kindlal temperatuuril, mida nimetatakse aine sulamistemperatuuriks. Sulamise ja tahkumise käigus aine temperatuur ei muutu, seetõttu on ka jäävee temperatuur alati 0 ºC.
Kuna jäävee temperatuur sulamise/jäätumise käigus ei muutu, siis järelikult ei muutu ka osakeste liikumiskiirus (kineetiline energia). Samas aine siseenergia peab sulades muutuma, kuna sulatamiseks antakse ainele energiat juurde. Seega muutub sulamise ja tahkumise käigus osakeste potentsiaalne energia: kui temperatuur tõuseb, siis osakesed nihkuvad üksteisest kaugemale ja suureneb vastastikmõju potentsiaalne energia.
Mõnedele ainetele on sulamiseks vaja rohkem energiat, teistele vähem. Seda, kui palju energiat on vaja aine sulamiseks, iseloomustab aine sulamissoojus.
Sulamissoojus näitab, kui palju energiat on vaja anda 1 kg sulamistemperatuuril olevale ainele, et see täielikult sulatada.
Sulamissoojust tähistatakse kreeka tähega (loe: lambda) ning ühikuks on . Jää sulamissoojus on , mis tähendab seda, et 1 kilogrammi jää sulamiseks kulub 330 000 J energiat. Kuna sulamine ja tahkumine on pöördprotsessid, siis 1 kilogrammi vee jäätumisel eraldub 330 000 J.
Aine sulamiseks vajaminevat soojushulka saab järelikult arvutada valemiga
kus tähistab sulamissoojust ja aine massi. Levinumate ainete sulamissoojused leiad Lisast 9.1.2 või näiteks Vikipeediast.
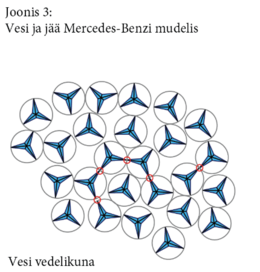
Enamikul ainetel on tahke olek tihedam kui vedel olek. Taas on üks erandlikke aineid vesi: jää tihedus on väiksem kui vee oma. Sel põhjusel tõuseb jää vees pinnale ja järved saavad endale talvel jääkaane. Kuid samas kahjustab vee selline omadus paljusid ehitisi. Näiteks lõhub jää asfaltteid: vesi tungib asfalttee kivide vahele, külmaga jäätub ning paisub ja teele tekivad praod.
Näidisülesanne
Mitu grammi 0-kraadist jääd tuleb lisada 200 grammi 20-kraadisesse vette, et vesi 0-kraadini jahutada?
Lahendus
Andmed
TeX parse error: Extra close brace or missing open brace
Arvutused
Leiame soojushulga, mis eraldub vee jahtumisel -ni. Temperatuurimuutus .
Vesi annab jahtumisel oma soojushulga jää sulamiseks . Teades jää sulamiseks minevat soojushulka, saame leida vajamineva jää massi . Et
siis
Vastus. Selleks, et jahutada 200 grammi vett -ni, on vaja vette lisada 50 grammi jääd.
Energy of melting and solidification
Melting a substance requires energy. Solidification releases energy.