Aine kolm olekut – tahke, vedel ja gaasiline - on tuttavad meile kõigile. Kuumutamisel muutuvad tahked ained vedelaks, edasisel kuumutamisel lähevad keema ja aurustuvad. Üldiselt see nii ongi, aga isegi igapäevaste loodusnähtuste jälgimisel võib märgata teatud kõrvalekaldumist sellest lihtsast reeglist. Vesi, lihtne, aga väga eriline aine, käitub selles mõttes väga viisakalt. Tavapärastel temperatuuridel esineb vesi tõesti kolmes olekus. Temperatuuri tõusu järjekorras: jää, vesi ja veeaur. Jääd ja vedelat vett teame kõik hästi, auruga on veidi keerulisem. Kuna veeaur on nähtamatu, st vaatlemisel õhuga täiesti sarnane, siis me kipume aurustumisega kaasnevat udu (väikeseid veepiisku) tihti veeauruks nimetama. See pole küll terminoloogiliselt ega sisuliselt õige, aga „kus udu, seal auru”, nii et teatud seos on siin olemas. Üks kõrvalekalle lihtsast kolme oleku mudelist on see, et vesi aurustub ka ilma keemiseta. Kui veeklaas lauale jätta, on see olenevalt tingimustest mõne päeva või mõne nädalaga tühi. Vähe sellest, jää võib ka ilma vedelaks muutumata „ära aurata”. Kui märg pesu talvekülmaga nöörile riputada, siis kuivab see tuule käes ära vaatamata sellele, et algul kõvaks külmub. Seda nähtust nimetatakse sublimeerumiseks. Jääkristallide sublimeerumine ei ole küll nii igapäevane nähtus kui vedela vee aurustumine, aga hea tahtmise juures täiesti märgatav ja mõõdetav. Paistab, et isegi lihtsate ainete korral tekib küsimusi. Kes on näinud vedelat süsihappegaasi või gaasilist süsinikku? Miks on ainete sulamis- ja keemistemperatuurid nii erinevad?
Aine oleku ja ülemineku ühest olekust teise määravad suures osas molekulaarjõud. Nagu me teame, hoiavad aatomeid molekulides keemilised sidemed. Aatomitevaheliste sidemete pikkused ja nendevahelised nurgad molekulis panevad olulises osas paika aine keemilised ja füüsikalised omadused. Keemilised sidemed, mida põhjustab laetud osakeste vaheline elektromagnetiline vastastikmõju, on üsna tugevad. Lisaks toimib aatomite ja molekulide vahel veel teisi, palju nõrgemaid jõude.
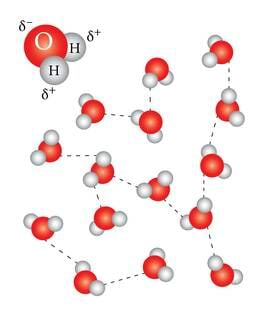
Molekulid kipuvad omavahel tõmbuma, kui nad üksteisele piisavalt lähedale satuvad. Tõmbumise põhjuseks on molekulide polaarsus. Aatomid on küll tervikuna elektriliselt neutraalsed, aga molekuli moodustades ei jaga nad elektrone ühtlaselt. Seepärast on paljud molekulid polaarsed, ühest kohast positiivse, teisest negatiivse laenguga (joonis 1.1.1.). Isegi molekulides, kus laengud on jagatud ühtlaselt, võivad elektronid ajutiselt ümber paikneda. Sellest tekib molekulide ajutine polariseerumine. Sama molekuli erinevate aatomite juures indutseeruvad erinimelised laengud, mille kaudu molekulid üksteist mõjutavad. Neid molekulidevahelisi, suhteliselt nõrku mõjusid nimetatakse van der Waalsi jõududeks.
Vesinikside. Ühendites, kus vesinik on seotud hapniku, lämmastiku või fluoriga (rühmad -OH, -NH ja -FH), on vesinikul positiivne osalaeng ja sideme teisel poolel negatiivne osalaeng. Selliste molekulide vesinikule kontsentreerunud positiivne laeng moodustab täiendavaid sidemeid teiste molekulide negatiivselt laetud aatomitega. Neid sidemeid kutsutakse vesiniksidemeteks. Vesiniksidemed võivad tekkida molekulide vahel. Näiteks moodustavad vee molekulid omavahel palju vesiniksidemeid, mis ongi suures osas vee väga eriliste omaduste põhjuseks. Vesiniksidemed võivad tekkida ka suurte molekulide sees, hoides biomolekule vajalikul viisil kokkupakituna. Vesiniksidemed on piisavalt tugevad, et molekule üksteisega seotuna hoida, samas piisavalt nõrgad, et elukeskkonna tavapärastel temperatuuridel katkeda. Sel moel on vesiniksidemed bionähtustes väga olulised. Vesiniksidet võib vaadelda kui teatud vahepealset nähtust molekulaarjõudude ja keemilise sideme vahel.
Hollandi füüsikateoreetiku, Amsterdami ülikooli esimese füüsikaprofessori Johannes Diderik van der Waalsi põhihuvi oli suunatud termodünaamikale. Tema nime kannavad peale jõudude veel reaalgaase kirjeldav van der Waalsi võrrand (Nobeli preemia 1910), mitmest molekulist koosnevad, molekulidevaheliste jõududega seotud van der Waalsi molekulid ja aatomite mõõtmeid kirjeldavad van der Waalsi raadiused. Eraldi väärib mainimist tema kapillaarsuse (ptk 1.7.) termodünaamiline teooria 1893. aastast, mis tekitas vaidlusi, sest molekulide ja soojusliikumise olemasolu ei olnud selleks ajaks veel üldiselt tunnustatud.
Aine kogust (üht tükki ainet), mis on kogu tervikuna samade füüsikaliste omadustega, nimetatakse faasiks. Vaatleme näiteks klaasitäit vett jääkuubikutega. Kuigi jää ja vesi on keemiliselt sama aine, on nende füüsikalised omadused ilmselt erinevad. Jää ja vesi on omakorda klaasis. Jääkuubikutega vees on: A) jääkuubikud, tahke faas; B) vesi, vedel faas, C) klaas, teine tahke faas, D) kui see kõik asub õhus, tuleb juurde veel gaasiline faas. Kõikide faaside vahel on piirpinnad, kus õhukeses kihis toimuvad pinnanähtused. Selge, et vee ja jää pinnakihis toimub sulamine, vee ja õhu piirpinnal aurustumine. Samas võib jää ja vee piirpinnal toimuda hoopis tahkumine, kui temperatuur on piisavalt madal. Vee ja õhu piirpinnal võib toimuda lisaks aurustumisele ka kondenseerumine ja gaaside lahustumine. Ka klaasi ja vee või klaasi ja õhu piirpinnal toimuvad teatud nähtused. Näiteks lahustuvad mõned klaasi komponendid vähesel määral vees. Kui vesi ei ole päris puhas, adsorbeeruvad lahustunud ained klaasile.
Kõigis neis näidetes on faasidevaheline piirpind ühtlasi erinevas olekus ainete piirpinnaks. Kuid esineb ka seda, et erinevad faasid moodustuvad samast ainest samas olekus. Kõige tuntum mitme tahke faasiga aine on süsinik, seda eelkõige tänu oma kahe loodusliku teisendi, grafiidi ja teemandi täiesti erinevatele füüsikalistele omadustele (ptk Faasidiagramm). Veelgi lisavad süsinikule kuulsust kunstlikult loodud teisendid (uued faasid), fullereen, grafeen jt.
Tahkete faaside eripära on kuju. Tahked kehad avaldavad vastupanu deformatsioonile, vedelikud ja gaasid seda ei tee. Samas on vedelatel ja tahketel faasidel ka ühiseid omadusi, näiteks kindel ruumala, mida ei ole jälle gaasidel. Seepärast kannavad tahked ja vedelad faasid ühist nimetust, kondensaine. Gaaside ja vedelike ühine omadus, kindla kuju puudumine, tingib nende voolavuse. Seepärast on nende ühine nimetus voolis. Esineb ained ja ainete segusid, kus selline lihtne sildistamine ei tööta kuigi hästi. Näiteks väga viskoossed vedelikud ja puisteained kipuvad tihti käituma kuidagi vahepealselt.
Aatomid, keemilised sidemed ja molekulide struktuur määravad ainete omadusi. Samas on paljud nähtused ja protsessid, mis ainetega toimuvad (olekute muutused, lahustumine, osmoos, pindpinevus), juhitud molekulaarjõududest. Molekulaarnähtuse hulgas on erilisel kohal see, mis toimub faaside piirpinnal, aine või faasi pinnakihis. Tuntuimad pinnanähtused on märgamine ja kapillaarsus, mis seostuvad vee ja teiste vedelike pinnakihi erilise omaduse, pindpinevusega (ptk Pindpinevus).
Mainime veel, et sõnal „faas“ on muidki tähendusi. Võnkumiste ja lainete, ka elektromagnetlainete, kirjeldamisel, astronoomias, meditsiinis, bioloogias ja materjalide töötlemisel on „faasil“ hoopis teised tähendused.
Esmapilgul tundub sulamine olevat lihtne nähtus. Vaatame, kuidas jääkuubikud vees sulavad. Jää sulamistemperatuur ja vee tahkumistemperatuur (jäätumistemperatuur) on 0°C. Samuti on jäätükkidega vee temperatuur null kraadi. Igapäevaselt tähendab see, et kui nullkraadine jäätükkidega veeklaas jätta lauale tasapisi soojenema, siis nii kaua, kuni jääd veel on, ei lähe jäätükkide vahel olev vesi soojemaks. Soojushulk, mis soojast toaõhust vette ja jäässe üle kandub, kulub jää sulatamiseks, mitte vee soojendamiseks.
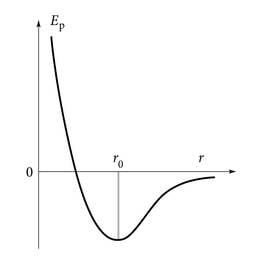
Tahkes olekus (näiteks kristallides) on molekulide (aatomite, ioonide) asukohad üksteise suhtes määratud keemiliste sidemete pikkuste ja sidemete asenditega. Öeldakse, et selline tahkis on atomaatselt korrastatud struktuuriga. Samas on molekulidele iseloomulik pidev, korrapäratu, kaootiline, juhusliku loomuga liikumine, mida nimetatakse soojusliikumiseks. Nii ei ole ka tahkes olekus molekulid omal kohal päris paigal. Piltlikult võib seda kujutada kui aatomite juhuslikku rabelemist talle määratud koha ümber. Molekule ja kristallvõret joonistades või vastavaid mudeleid kokku pannes kujutatakse aatomeid ainult lihtsuse mõttes paigalseisvate kerakestena. Aatomitevahelise kauguse määrab siin ära potentsiaalse energia miinimumi printsiip. Aatomid asuvad üksteisest keskmiselt sellisel kaugusel, kus neil on „kasulik” olla, kus nendevahelise seose energia on kõige väiksem (joonis 1.1.3.).
Igapäevaelukogemustest on hästi teada, et sulatamiseks on vaja energiat kulutada, st ainet on vaja soojendada. Energia jäävuse seadus ütleb, et ainete tahkumisel peab sama suur kogus energiat eralduma. Näiteks 1 kg alumiiniumi sulatamisel tuleb kõigi aatomite potentsiaaliaugust (joonis 1.1.3.) väljatoomiseks teha kokku 321 kJ tööd. Seda kokkulepitud ainekoguse (ühikulise massi) sulatamiseks kuluvat soojushulka nimetatakse sulamissoojuseks. Kui sulaalumiinium vormi valatakse ja tahkuda lastakse, siis lähevad aatomid jälle oma minimaalse energiaga kohtadele tagasi (kaugus üksteisest r0) ja sulatamiseks kulutatud soojushulk eraldub. Tahkumisel eralduvat soojust on võrreldes sulamiseks kuluvaga raskem märgata. Tundub üsna loogiline küsida, kas tõesti kinnikülmuv järv soojendab jääkristallide moodustumisel vabaneva energia arvel iseennast ja ilma. Kuigi see võib intuitiivselt paista veidi kahtlane, siis just nii see ongi. Veekogud saavad külmuda ainult siis, kui õhk on piisavalt külm, et tahkumisel eralduv soojushulk vastu võtta ja ära kanda.
Selline sulamist kirjeldav molekulaarmudel on õige mitmetel lihtsatel juhtudel, aga tegelikult on palju aineid ja suur hulk nähtusi, kus sulamise ja tahkumise kirjeldamine on hoopis keerulisem.
Näiteid pole vaja kaugelt otsida. Mitmed ained esinevad ainult gaasi ja tahkisena. Süsihappegaas, nagu nimetuski ütleb, on tuntud enamasti gaasina. Tahket süsihappegaasi on võimalik valmistada nii süsihappelume kui kuiva jääna, aga vaevalt on keegi näinud vedelat süsihappegaasi. Kuiv jää normaalrõhul ei sula, vaid muutub gaasiliseks ilma vahepealse vedela olekuta ehk sublimeerub (ptk Faasidiagramm).
Segude (näiteks sulamite) sulamisel ja eriti tahkumisel sõltub palju komponentide vahekorrast ja temperatuurimuutuse kiirusest. Metallide tehnoloogias on teadmised neist protsessidest väga olulised. Näitena meenutame, kuidas muudab raua tahkumist ja saadud materjali omadusi mõneprotsendiline süsinikusisaldus (teras, malm) või jahtumisrežiim (karastamine).
Kuigi üldiselt on sulamis- ja tahkumistemperatuur võrdsed, on võimalik ka vedelike allajahtumine. Näiteks puhta vee temperatuur võib langeda alla null kraadi, ilma et jääkristallid tekiksid. Paistab, et jäätumine ei „suuda otsustada”, kuhu tekib esimene kristallike. Sellise vedeliku paneb kiiresti tahkuma vähimgi häirimine, nt loksutamine või lisandid. Samamoodi võib aur alla jahtuda. See juhtub tihti veeauruga atmosfääris ja on oluline nähtus pilvede tekkimisel (ptk Kastepunkt. Ilm ja kliima).
Kristalsetel ainetel on olemas kindel sulamistemperatuur. Aga on olemas hulk amorfseid aineid, mis muutuvad vedelikuks teatud temperatuurivahemikus ja ka nende tahkumine ei sarnane sugugi vee jäätumisega. Näidetena väärivad eelkõige nimetamist pigi, vaha, termoplastilised polümeerid ja klaas. Klaas on nende hulgas nii eriline ja oluline, et sellele sarnaseid, molekulaarstruktuurilt korrastamata ja seepärast ka täpse sulamistemperatuurita aineid nimetataksegi tihti klaasideks. Kuumutamisel muutuvad klaasid algul pehmeks ja temperatuuri tõusuga viskoossus väheneb, kuni saabub üsna tavalise vedeliku sarnane olek. Seepärast võib öelda, et klaasidel sulamistemperatuuri ei ole.
Tuleb siiski märkida, et on mitmeid omadusi (soojuspaisumine, erisoojus), mis klaasi sulatamisel muutuvad palju järsemalt kui viskoossus. Temperatuuri, mille juures mingi füüsikaline omadus järsult muutub, nimetatakse siirdetemperatuuriks.
Olek ei pea siirdetemperatuuril järsult muutuma. Nagu me kõik klaasi näite varal teame, on amorfsed materjalid siirdetemperatuurist oluliselt madalamal temperatuuril vägagi kristalsete ainete sarnased. Külma ilmaga võib pigi haamriga kildudeks lüüa, kuigi kuumal suvepäeval kipub ta laiali valguma. Mitmed igapäevastel temperatuuridel elastsed või plastilised ained muutuvad külma käes ootamatult hapraks. Näiteid võib leida nii igapäevaelust kui kosmosetehnikast.
Klaasi amorfsete omaduste tõestuseks kirjeldatakse tihti väga vanade aknaklaaside alumise serva paksemaks vajumist. Kuna klaasil on omadusi, mis lubavad teda pidada mitte kristalseks aineks, vaid väga suure viskoossusega vedelikuks, siis sadade aastatega võiksid aknaklaasid tasapisi allapoole voolata ja alt paksemaks muutuda. Tegelikult ei ole selle nähtuse esinemise kohta selgeid tõendeid. Vanad aknaklaasid on tõepoolest enamasti alt paksemad. Samas ei ole kusagil märgatud raamidest väljavajumist ja muid nähtusi, mis peaksid ilmnema viskoosse vedeliku valgumisel. Miks on siis keskaegsed kirikuakende klaasid alumisest servast paksemad?
Erinevad klaasisordid on erineva keemilise koostisega ja nende füüsikalised omadused on erinevad. Klaasi pehmenemise temperatuurivahemik on sorditi erinev. Kuumuskindlad sordid ja optiline klaas on selles mõttes sarnasemad kristallidega, akna- ja pudeliklaas käitub laiemas temperatuurivahemikus viskoosse vedelikuna. Tootmise ja klaasikunsti, eriti klaasipuhumise jaoks on see omadus oluline. Näiteks kroonklaasi meetodi etappideks olid suure anuma puhumine, lahtilõikamine ja selle klaaskettaks vormimine. Peaaegu vedelast klaasist puhutud pudeli põhi on lahti lõigatud ja kiire pöörlemise tulemusel venib ikka veel poolpehme klaas üha suuremaks, tasasemaks ja õhemaks kettaks. Tehnoloogia ja klaasisordi nimi tulevad sellest, et pudelist siledaks kettaks venimisel on toorik vahepeal kroonikujuline. Saadud ketas lõigatakse pärast ettevaatlikku jahutamist tahvliteks. Seejuures on hea, kui klaas püsib laiemas temperatuurivahemikus pehme ja vormitav. Saadakse üsna suured klaaskettad, mis on paratamatult keskelt paksemad kui servast. Nende tahvliteks lõikamisel saadud aknaklaasi üks serv või nurk jääb paksem. Tuleb tunnistada, et me ei tea, miks ehitajad paigaldasid klaasi alati või vähemalt valdavalt paksema servaga allapoole, aga on üsna selge, et just nii nad tegid. Ka kõigis muudes kohtades peale akende, kus vana klaasi on leitud, ei ole märgata voolamisega sarnanevat deformatsiooni. Näiteks maa seest või varemete alt välja kaevatud klaasesemed ei ole sajanditega kuidagi pinnase või kivide survele järgi andnud. Klaas on igapäevase õhutemperatuuri juures ikkagi lihtsalt tahke aine.
Sulamistemperatuuri määramiseks on mõistlik võtta võimalikult väike ainekogus (peenikeses torus, õhukese kihina) ja lasta temperatuuril aeglaselt tõusta, jälgides samal ajal ümbritseva keskkonna temperatuuri. Sulamise hetke on kerge märgata, muutus on selgelt näha. Samuti on võimalik mitmesuguste anduritega registreerida aine optiliste või soojuslike omaduste muutust sulamise hetkel ja salvestada samal hetkel temperatuurinäit.
Lihtsas sulamistemperatuuri määramise seadmes on elavhõbetermomeetri reservuaari külge on kinnitatud peenikeses klaasist torukeses (d≈1 mm) peenestatud aine. Termomeeter on pannakse õliga täidetud anumasse, Thiele katseklaasi, mida gaasipõletiga aeglaselt kuumutatakse. Sulamistemperatuuri vaadatakse hetkel, kui aineproov muutub läbipaistvaks, st vedelaks.
Aine olekud, keemilised sidemed, molekulaarijõud
Aine olekud ja olekumuutused on määratud keemiliste sidemete ja molekulaarjõudude iseloomuga.
Tahkis
In solids (solid bodies), the particles of matter are close together. In the solid state, the kinetic energy of the particles of matter is much smaller than the potential energy of the attractive forces acting between the particles. The peculiarity of solids is revealed by deformation: only solids resist deformation. The common property of liquids and solids is the conservation of volume, which is why they are called condensates.