Nüüd, kui teame juba üsna palju aine erinevatest olekutest ja faaside vahelisest piirpinnast, võib veelkord tagasi tulla faasisiirete juurde, kõigepealt aine agregaatolekute muutumise teemasse.
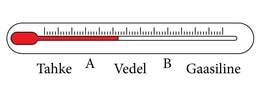
Ühe konkreetse aine olekuid (laiemalt võttes kõiki faase) võib kujutada arvteljel, nagu külili asetatud termomeetril (joonis 1.9.1.). Sellel arvteljel on kaks olulist punkti, A) sulamis- ja tahkumistemperatuur; B) keemis- ja kondensatsioonitemperatuur. Need temperatuurid on aineti erinevad ja seepärast on igal ainel vedela oleku vahemik erineva pikkusega ja erinevas kohas.
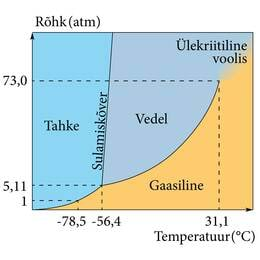
Selline pilt (joonis 1.9.1.) kehtib ainult muutumatu rõhu korral, sest sulamistemperatuur ja eriti keemistemperatuur (joonis 1.2.2.) sõltuvad välisrõhust. Näiteks vee korral on atmosfäärirõhul sulamistemperatuuri ja keemistemperatuuri vahe 100 kraadi. Kõrgemal rõhul on see vahe pikem, madalamal lühem. Et saada täit pilti aine olekute muutustest kõigil rõhkudel, ei piisa ühest arvteljest. Kui aga lisada joonisele 1.9.1. veel sulamise ja keemise andmeid kõrgematel ja madalamatel rõhkudel, saame aine olekute graafilise esituse, mida nimetatakse olekudiagrammiks (joonis 1.9.2.). Olekudiagrammi kõverad kujutavad tingimusi, kus toimub üleminek ühest olekust teise. Tahke ja vedela oleku vahel on sulamiskõver, vedela ja gaasilise piiril on keemiskõver, tahket ja gaasilist olekut eraldab sublimatsioonikõver. Keemiskõveral on keemistemperatuurid erinevatel rõhkudel, sulamiskõveral sulamistemperatuurid erinevatel rõhkudel. Kõverate vahele jäävad alad vastavad tingimustele (rõhk ja temperatuur), mille juures aine on gaasilises, vedelas või tahkes olekus.
Tavaliselt on ainete nii keemis- kui sulamiskõver kaldu kõrgemate temperatuuride poole, aga keemiskõvera kalle on suurem, st et rõhk mõjutab keemist rohkem kui sulamist. Igal diagrammil on üks punkt, kus kõverad kohtuvad. Kuna selles punktis kohtuvad ka aine kolme olekut (gaasilist, vedelat ja tahket) kujutavad diagrammi alad, siis on selle nimi kolmikpunkt.
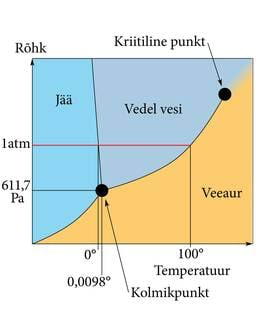
Kui aine temperatuur ja rõhk on faasidiagrammil sulamiskõveral, võib aine korraga olla tahkes ja vedelas olekus, näiteks jääkuubikud vees. Keemiskõverale vastavatel tingimustel esinevad korraga gaas ja vedelik, näiteks aurumullid keevas vedelikus. Kolmikpunkti tingimused võimaldavad ainel olla korraga kolmes olekus. Keevas vedelikus on siis koos nii aurumullid kui ka tahkise tükid. Igapäevaelus me sellist olukorda ei kohta, sest sellised tingimused on üsna haruldased. Igal ainel on ju ainult üks kolmikpunkt. Me elame atmosfääris, mille rõhk on üsna püsiv, umbes üks atmosfäär (1 atm=101325 Pa). Kui me leiaks aine, mille kolmikpunkt on atmosfäärirõhul ja jääb ka elukeskkonna tavalisse temperatuurivahemikku, oleks tõesti võimalik kolme olekut korraga ühes nõus vaadelda. Lihtsate tehniliste vahenditega võib sellise olukorra saavutada veega, meie lemmikainega (joonis 1.9.3.).
Keemiskõveral on veel üks eripära kõrgel temperatuuril ja suure rõhu all. Gaas ja vedelik erinevad tiheduse poolest, vedelike tihedus on suurem. Vedelikud paisuvad kuumutamisel ja nende tihedus väheneb. Teiselt poolt suureneb gaaside tihedus kokkusurumisel. Nii juhtubki, et keemiskõver katkeb ühes punktis, mida nimetatakse kriitiliseks. Sellest punktist edasi pole enam võimalik kokkusurutud gaasil ja paisunud vedelikul kindlat vahet teha. Vastuseta jääb küsimus, kas tegemist on vedeliku tiheduseni kokku surutud gaasiga või gaasisarnaseks paisunud vedelikuga. Ülekriitilises voolises ei saa olla olekutevahelist piirpinda. Pajude tuntud gaaside kriitiline temperatuur on üsna madal. Näiteks metaani (maagaasi) kriitiline punkt on T= 190,7 K (−82,5 °C), p = 46 bar (45,4 atm). Sellest on näha, et igapäevastel temperatuuridel ei saa muuta maagaasi kokkusurumisega pärisvedelikuks. Küll aga saab seda teha jahutamisega.
On üsna loogiline arvata, et ained, mida me gaasideks nimetame, veelduvad madalal temperatuuril ja lõpuks väga-väga madalal temperatuuril tahkuvad. Sellel arvamusel on tõepõhi all, kuid siingi ei saa mööda rõhu küsimusest. Tõepoolest, paljud gaasid veelduvad atmosfäärirõhul, mõned neist väga madalal temperatuuril. Vesiniku keemistemperatuur on 20,28 K (−252,87°C), heeliumil koguni 4,22 K (−268,93°C). Veeldumise mõttes on erandiks ained, mille kolmikpunkt on tavalisest õhurõhust kõrgemal. Sellistest gaasidest ilma rõhku tõstmata vedelikku ei saa. Tahkumise osas jääb erandiks heelium. Ülimadalatel temperatuuridel ilmutab heelium ootamatuid füüsikalisi omadusi (näiteks ülivoolavus) ja tahkeks ta atmosfäärirõhul ei muutugi. Tahke heeliumi saamiseks on vaja rõhku tõsta.
Süsihappegaasi me tunneme igapäevaelus gaasina, tal on isegi vastav nimi. Olekudiagrammi (joonis 1.9.2.) atmosfäärirõhu horisontaali vaadates märkame, et atmosfäärirõhul süsihappegaas ei veeldu (ei kondenseeru vedelikuks), kuitahes osaval jahutamisel. Võib tunduda, et me just seepärast nimetame teda gaasiks, aga päris nii see siiski ei ole. Paljud ained, mida me ikka ja ainult gaasidena tunneme, veelduvad ja tahkuvad üsna sarnaselt veega, st kolmikpunkt on neil allpool atmosfäärirõhku. Näiteks lämmastik veeldub temperatuuril −195,79°C ja tahkub −210°C juures ilma rõhku muutmata.
Kolmikpunktist allpool, st madalmatel rõhkudel ei ole temperatuuri muutmisega võimalik ainet vedelaks muuta. Süsihappegaas (kolmikpunkt T=216,6 K, p=518kPa) on atmosfäärirõhul ainult gaasiline või tahke. Temperatuuril −78,5°C moodustab süsihappegaas härmatise (süsihappelume), mis samal temperatuuril sublimeerub, kui teda soojendada. Soojendamiseks ei ole muidugi vaja muud kui hoidmist toasoojas õhus. Tegelikult on isegi korralik talvepakane tahkunud süsihappegaasile „liiga soe”. Vedelas olekus võib süsihappegaas olla kõrgemal rõhul, nii teda balloonides hoitaksegi. Väljalaskmisel vedelik aurustub ja sellest tuleneva jahtumise tõttu osa tahkub, moodustades süsihappelume, mille pressimisel saadakse nn kuiv jää.
Oleme jälle mitmel korral võtnud näiteks jää, vee ja veeauru. Vee kolmikpunkt on atmosfäärirõhust madalamal, kõik kolm olekut meile hästi tuttavad ja selles mõttes on vesi hea näide. Kuid sellel, niigi erilisel ainel, on ka olekudiagramm ebatavaline. Sulamiskõver ei kaldu rõhu tõustes kõrgemate temperatuuride poole, vaid tavaliste olekudiagrammidega võrreldes nö vales suunas.
Me teame, et vee tahkumisega (jäätumisega) kaasneb ruumala suurenemine, mille tõttu on jää tihedus väiksem kui vedelal veel. Jää ujub vee peal, mis on oluline elu tekke ja kliima stabiilsuse seisukohalt, sest pinnajää kaitseb veekogusid põhjani külmumise eest. Sarnane füüsikaline omadus on tõesti väga vähestel ainetel, peale vee käituvad nii räni, vismut ja veel mõned metallid. Kuid veel on teisigi tavatuid omadusi. Näiteks väga suur erisoojus ja see, et kõrgel rõhul on sulamistemperatuur veidi madalam, mitte kõrgem nagu tavalistel ainetel. Selle eripäraga on püütud seletada jää libedust. Jäätunud tänaval kõndides avaldame me jääle rõhku ja seega on saapataldade all sulamistemperatuur madalam. Võiks arvata, et just seepärast sulab osa jääst veeks ja muudab pinna libedaks. Olekudiagrammi vaadates on ilmne, et see seletus paika ei pea. Sulamiskõvera kalle on liiga väike. Isegi päris suur rõhk vähendab sulamistemperatuuri mõne kraadi võrra, aga jää on libe ka väga külma ilmaga ja üsna väikese rõhu (suured saapad, suusad) korral. Jää libedust on püütud seletada hõõrdumisest tingitud sulamisega, aga seegi hüpotees pole kinnitust leidnud. Tänapäeval peetakse kõige tõenäolisemaks, et jää lihtsalt ongi libe aine. Jääkristallide väga õhuke pinnakiht on pidevalt vedelikusarnases olekus ja see teebki ta libedaks. On omamoodi hämmastav, et 21. sajandi algul on nii igapäevase aine omadused jätkuvalt tõsiseks uurimisteemaks.
Olekudiagrammilt näeme, millistel rõhkudel ja temperatuuridel on sama aine erinevates olekutes. Ainete omadused on erinevates olekutes teistsugused. Gaasid ja vedelikud on voolavad, tahkised mitte. Gaasid on kokkusurutavad, vedelikud ja tahkised mitte. Paljud teisedki omadused on eri olekutes erinevad. Kuid sama aine võib tahkes olekus (ja mõnel juhul ka vedelikuna) ilmutada erinevaid füüsikalisi omadusi ainuüksi aatomite erineva paigutuse tõttu. Sel juhul räägime aine erinevatest faasidest (ptk Faasid). Muidugi on ka olekud erinevad faasid, sest kindlate omadustega ainekogus on teistsugusest ainekogusest piirpinnaga eraldatud. Nagu saime koostada olekudiagrammi tingimuste kohta, mille juures on aine teatud olekus, nii saame ka koostada faasidiagrammi.
Paljude ainete korral toimub üleminek ühest olekust teise kindlal temperatuuril. Sulamise, tahkumise, keemise ja kondenseerumise nähtusi kirjeldasime []sulamise, tahkumise, gaaside ja vedelike peatükkides[]. Samuti võib üleminek (siirdumine) ühest faasist teise toimuda kindlal temperatuuril, mida nimetatakse siirdetemperatuuriks. Seejuures ei pruugi muutuda aine olek, küll aga muutub mingi füüsikaline omadus. Faasisiirete energeetilist efekti kirjeldavad siirdesoojused, nagu näiteks sulamissoojus kirjeldab sulatamiseks kuluvat või tahkumisel eralduvat soojushulka.
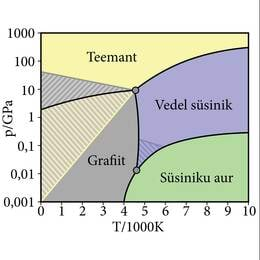
Tahkete faaside üleminekul (faasisiirdel) on olekumuutusega võrreldes üks küllalt oluline erinevus. Vaatame näitena süsiniku faasidiagrammi, joonis 1.9.6. Sulamis-, keemis- ja sublimatsioonikõver on üsna sarnased sellega, mida nägime olekudiagrammil (joonis 1.9.2.). Tahke oleku kohale on märgitud grafiit ja lisaks väga kõrgel, ülisuurte rõhkude piirkonnas on kirjas teemant. Teemandid on täiesti olemas atmosfäärirõhul ja toatemperatuuril, aga faasidiagramm näitab tavatingimustes ainult grafiiti. Siin ilmnebki tahkete faaside eripära. Nimelt „elavad” mõned faasid päris edukalt võõrastes tingimustes. Süsinik ei muutu kuidagi iseenesest teemandiks, aga kui see on kord juba juhtunud kõrge rõhu toimel, säilitab teemant oma piirpinna ja füüsikalised omadused uskumatu visadusega.
Süsinik käitub ühest faasist teise üleminekul eriliselt, säilitab oma faasi (st piirpinna ja füüsikalised omadused) kaugel väljaspool faasidiagrammis „talle eraldatud ala”. Mitte kõik faasid ei ole nii visad püsima. Näiteks on hästi tuntud tina millel on kaks tahket faasi, α- ja β- tina. Hõbevalge läikega metalliline β-tina muutub madalal temperatuuril halliks pulbriliseks α-tinaks. Tina faasisiire valgest tinast halliks on autokatalüütiline (kord juba alanud üleminek areneb üha kiirenevalt) ja on võimeline teisi esemeid „nakatama”. Sellepärast nimetatakse nähtust tinakatkuks.Tina saab kuumutamisel oma metallilised omadused tagasi, aga tinast valmistatud esemed on nende üleminekute käigus pöördumatult kadunud.
Tinakatku kohta räägitakse uskumatuid lugusid, mille tõepära üle vaieldakse tänaseni. Napoleoni sõdurid olevat kaotanud külmas Vene talves mundrite tinanööbid ja nagu teada, lõppes sõjakäik lüüasaamisega. Polaaruurijatega juhtunud äparduste nimekirjas on tinaga joodetud toidu- ja kütusenõude lagunemised. Kõige rohkem on kirjutatud Robert Falcon Scotti juhitud retkest lõunapoolusele, kus väga külmades tingimustes olevat lagunenud tinaga joodetud kütuse- ja toidunõud. Katk kahjustab kergesti puhast tina, paljud tinasulamid (isegi väikese lisandiga) on üsna külmakindlad. Tänapäevased mürgiste metallide (plii, kaadmiumi, antimoni) kasutuspiirangud on puhta tinaga jootmise uuesti ausse tõstnud, kuid see võib tekitata probleeme külma käes töötavas elektroonikas.
Tehisteemantide saamise plaani pidasid teadlased juba 18. sajandi algul, kohe pärast seda, kui sai selgeks, et teemant on lihtaine, puhas süsinik. Muidugi oli kaugem lootus valmistada briljantide lihvimiseks sobivaid suuri kive. Teemandi eriline kõvadus pakkus samas tehnilist huvi ja praktilist kasutust leiavad ka pisemad tükid, isegi teemandipuru kulub ära. Looduslikud leiukohad annavad aimu sellest, et kõrge rõhk ja temperatuur on teemantide tekkimisel olulised olnud. Nii proovitigi grafiiti mitmesugusel viisil kuumutamise, pressimise ja jahutamisega teemandiks muuta. Mitmed katsed kuulutati õnnestunuks, aga korduskatsed äpardusid alati. Praegused teadmised aine ehitusest panevad meid uskuma, et varasemates katsetustes saadi küll huvitavaid kristalle, aga teemandid need siiski ei olnud. Esimeste tehisteemantide valmistamiseni jõuti alles 20. sajandi keskel. See on küll selgelt tagantjärele tarkus, aga faasidiagrammi vaadates on nüüd ilmne, et kui lihtsalt väga suure rõhuga teemandid ei teki, siis võiks oodatud tulemuseni „hiilida” läbi vedela või gaasilise oleku. Tegelikult osutus teemantide tootmine tehniliselt palju keerulisemaks, seostudes näiteks süsiniku lahustumisega vedelates metallides. Tänaseks on mitu oleku muutusega seotud tehnoloogiat osutunud edukaks. Tehnilise teemandipuru tootmine on isegi nii odav, et igaüks võib mõõduka hinna eest osta ehituspoest teemantsae või teemantpuuride komplekti.