Selles peatükis jätkame juttu sellest, kuidas jõuti füüsika ühe põhieesmärgini: aatomite olemasolu ja omaduste väljaselgitamiseni. Umbes sada aastat tagasi ponnistasid füüsikud jõudu, et leida katset, mis vaieldamatult tõestaks aatomite olemasolu. Tänapäeval ei kahtle keegi selles, et aatomid olemas on. Tunnelmikroskoobis me lausa näeme üksikaatomeid. Võime neid nihutada mööda pindu, näiteks selleks, et moodustada kvantkopleid, nagu 39. peatüki avafotol kujutatud. On kogunisti võimalik hoida üksikaatomit kuitahes kaua püünises (joonis 40-1), et uurida teistest täielikult isoleeritud aatomi omadusi.
Võidakse arvata, et aatomifüüsika on argielust üpris kaugel. Kummatigi, kas olete mõelnud, kuidas meid mõjutavad aatomite järgmised omadused?
Aatomite püsikindlus. Valdav osa aatomeid, mis moodustavad meie maailma, on eksisteerinud muutumatult miljardeid aastaid. Maailm oleks ju lausa pöörane, kui aatomid alatasa teistsugusteks muutuksid.
Aatomid ühinevad üksteisega. Need „kleepuvad” kokku molekulideks ja kuhjuvad tahkisteks. Suurem osa igast aatomist on tühi ruum, kuid ometi võime julgesti seista aatomeist moodustunud põrandal ega kuku sellest läbi.
Kvantfüüsika annab seletuse nii nendele kui ka aatomite järgmistele omadustele.
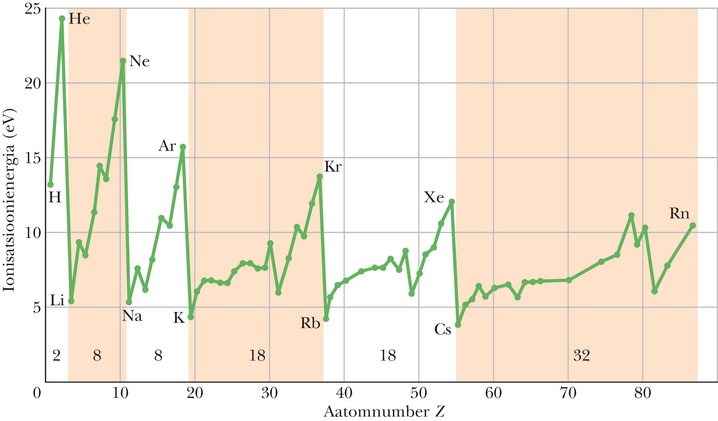
Joonisel 40-2 on näide aatomite omaduste korduvusest nende perioodilisussüsteemis (Lisa G). Graafikul on elementide ionisatsioonienergia sõltuvus nende aatomnumbrist ehk teisisõnu elemendi asendist perioodilisussüsteemis. Ionisatsioonienergia on minimaalne energia, mis kulub kõige nõrgemini seotud elektroni eemaldamiseks aatomist. Elementide keemiliste ja füüsikaliste omaduste silmatorkav sarnasus perioodsustabeli igas püsttulbas näitab veenvalt, et aatomid koostuvad reeglipäraselt.
Perioodilisussüsteemis on elemendid järjestatud kuude täielikku horisontaalsesse perioodi (seitsmes periood ei ole täielik). Kui esimene periood välja arvata, siis algab igaüks neist vasakul ägeda reaktsioonivõimega leelismetalliga (liitium, naatrium, kaalium jne) ja lõpeb paremal inertse väärisgaasiga (neoon, argoon, krüptoon jne). Kvantfüüsika annab seletuse nende elementide omadustele. Elementide arv kuues perioodis on järgmine:
Ka need arvud johtuvad kvantfüüsikast.
Veendusime juba, et aatomid võivad olla üksnes diskreetsetes kvantolekutes, milledest igaühel on kindel energia. Aatom võib siirduda ühest olekust teise, kiirates (hüpates madalamale tasemele ) või neelates valgust (hüpates kõrgemale tasemele ). Punktis 39-3 selgitati, et valgust kiiratakse või neelatakse footonina, mille energia on
Seega taandub aatomi poolt kiiratava või neelatava valguse sageduse leidmine aatomite kvantseisundite energia arvutamisele; seda võimaldab kvantfüüsika, vähemalt põhimõtteliselt.
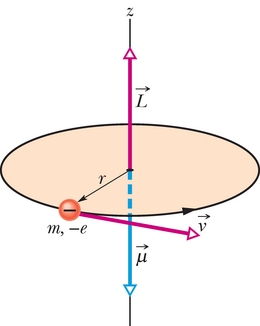
Joonisel 40-3 on negatiivse laenguga osake, mis tiirleb ringorbiidil paigaloleva keskme ümber. Nagu selgus punktis 32-7, on orbiidil tiirleval osakesel nii impulsimoment kui ka magnetiline dipoolmoment . (Viimane seepärast, et selle trajektoor on ekvivalentne miniatuurse vooluringiga). Joonis 40-3 näitab, et mõlemad vektorid ja on risti orbiidi tasandiga, kuid, kuna laeng on negatiivne, siis on need vastassuunalised. Joonis 40-3 kujutab klassikalist mudelit, seepärast ei esita see elektroni aatomis õigesti. Kvantfüüsikas tuleb elektron asendada tõenäosustiheduse mudeliga, mida kõige paremini näitlikustab täpp-pilt. Kuid ka kvantfüüsikas kehtib tõik, et elektroni igal kvantseisundil on (üldiselt) impulsimoment ja sellele vastassuunaline magnetdipoolmoment (öeldakse, et need on seostatud suurused).
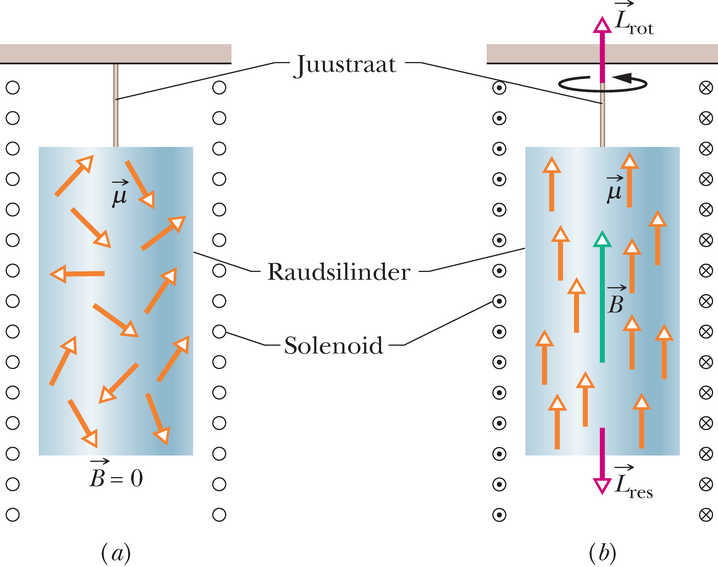
Aastal 1916 sooritasid Albert Einstein ja Hollandi füüsik W.J. de Haas ühiselt nutika katse näitamaks, et üksikaatomite impulsimoment ja magnetmoment on omavahel seotud.
Katse skeem on toodud joonisel 40-4. Nad riputasid raudsilindri peene traadi otsa ja paigutasid selle siis solenoidi. Kui solenoidis puudub vool, on aatomite magnetmomendid kaootilised, kindla suunata, ning tühistavad üksteist vastastikku (joonis 40-4a). Niipea kui solenoidi lülitatakse vool, mis tekitab solenoidi telje suunas magnetvälja , pöörduvad aatomite magnetmomendid välja suunaga paralleelseks. Ühtlasi peavad siis pöörduma ka magnetmomendiga seostatud impulsimomendid .
Silindrile ei mõju mingit välist jõumomenti, seepärast peaks selle impulsimoment jäämagi nulliks. Kuid aatomite impulsimomente suunav magnetväli tekitab silindrile mõjuva makroskoopilise momendi (joonis 40-4b). Et säilitada impulsimomenti (mis alguses oli null), siis pöördub silinder ümber oma telje, et tekitada vastassuunalist momenti.
Kui silinder ei ripuks elastse juustraadi otsas, jääkski see pöörlema seniks, kuni magnetväli mõjub. Kuid traadi vääne tekitab vastassuunalise momendi, mis peagi silindri peatab ja seda vastassuunas pöörama hakkab, seni kui vääne kaob. Sedasi hakkab silinder telje ümber harmooniliselt võnkuma. (Võnkumisi hoitakse solenoidi vahelduvvoolu suunates.) Silindri pöördvõnkumine tehakse nähtavaks traadi külge kinnitatud peeglilt peegelduva valguskiire suunamuutuse kaudu.
See katse näitas ilmekalt, et aatomite kvantseisunditega seotud impulsimomendid on makroskoopilise objekti pöörde järgi lausa silmaga vaadeldavad.
Punktis 32-7 seletati, et elektronil on alati siseomane spinnimpulsimoment ehk lihtsalt spinn . See on elektroni püsiomadus, sama moodi kui mass ja elektrilaeng. Järgmises punktis näitame, et spinn on kvanditud, s.t määratud spinnkvantarvuga , mis on elektronidel, prootonitel ja neutronitel alati . Lisaks on kvanditud ka spinni komponent piki suvalist telge. See sõltub spinni magnetkvantarvust , mis omandab üksnes väärtusi ja .
Elektroni spinni olemasolu postuleerisid katsele tuginedes kaks Hollandi doktoranti, George Uhlenbeck ja Samuel Goudsmit. Teoreetiliselt tõi spinni sisse Inglise füüsik P.A.M. Dirac, kes rajas 1929. aastal elektroni relativistliku kvantteooria.
Tihti tekib kiusatus tõlgendada elektroni spinni käsitades elektroni kerakesena, mis pöörleb ümber oma telje (sellest nimetuski: ingl to spin – ketrama, pöörlema). Kuid see klassikaline mudel, niisamuti kui orbiitide mudelgi, pole pädev. Õigem on pidada spinni elektroni mõõdetavaks siseomaduseks. Seda ei saa näitlikustada.
Punktis 39-9 tõime välja kvantarvud, mis tulevad esile Schrödingeri võrrandi rakendamisel vesiniku aatomile (tabel 39-2). Nüüd võime kvantarvude tabelit laiendada, võttes hulka ka arvud ja (tabel 40-1). Viie kvantarvu komplekt iseloomustab täielikult elektroni kvantseisundit vesiniku aatomis või mistahes teiseski aatomis. Kõik seisundid, millel on ühine kvantarv , moodustavad
elektronkihi. Loendades ja väärtusi ja siis korrutades selle tulemuse kahega, et arvestada ms kaht lubatud väärtust, leiame, et elektronkiht sisaldab seisundit. Kõik seisundid ühesuguse ja väärtusega moodustavad alamkihi. Selles on kõikidel elektronidel üks ja sama energia. Võite rehkendada, et alamkiht, mida iseloomustab kvantarv , sisaldab olekut.
Aatomi iga kvantseisundiga on seotud orbitaalne impulsimoment ning temale vastav magnetiline dipoolmoment. Igal elektronil, ükskõik kas aatomisse lõksustatul või vabal, on spinnmoment ja temaga seotud magnetmoment. Käsitleme neid suurusi esiteks ühekaupa, siis kõiki koos.
Orbitaalse impulsimomendi suurus on aatomis kvanditud, s.t see omandab vaid väärtusi
kus on orbitaalkvantarv ja tähistab suurust . Tabelist 40-1 on näha, et on kas null või positiivne täisarv, väiksem kui . Näiteks kui n=3, siis on lubatud väärtused ja .
Punktis 32-7 nägime, et magnetiline dipool on seotud aatomis oleva elektroni orbitaalse impulsimomendiga . Magnetdipoolil on orbitaalne magnetiline dipoolmoment , mis on seotud impulsimomendiga seose 32-28 kaudu:
Miinusmärk on valemis seepärast, et ja on vastassuunalised. Kuna on kvanditud, peab ka olema kvanditud:
Ei ega ka ole mõõdetavad. Mõõdetavad on üksnes nende kahe vektori komponendid mistahes suunas. Kujutleme, et aatom asub magnetväljas ; eeldame, et
-telg on suunatud piki magnetvälja jõujooni kohas, kus aatom asub. Siis saame mõõta nii kui ka -komponente.
Orbitaalse magnetilise dipoolmomendi komponendid on kvanditud ning avalduvad kujul:
Siin on magnetkvantarv (vt tabel 40-1) ja on Bohri magneton:
Impulsimomendi -komponendid on samuti kvanditud ja avalduvad järgnevalt:
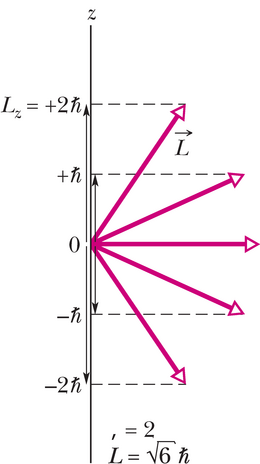
Joonisel 40-5 on näidatud viis orbitaalmomendi kvanditud komponenti elektronil, mille ℓ=2. Ühtlasi on toodud ka impulsimomendi orientatsioonid. Kuid joonist ei maksa ülearu usaldada, sest pole mingil moel määratav. Seepärast võib joonist käsitada üksnes kui visuaalset abivahendit. Võime kokkuleppeliselt öelda, et asetub -telje suhtes teatava nurga all, mis rahuldab seost
Nurka võiksime nimetada poolklassikaliseks nurgaks vektori ja -telje vahel, sest on millegi sellise klassikaline mõõt, mis kvantteooria järgi mõõdetav pole.
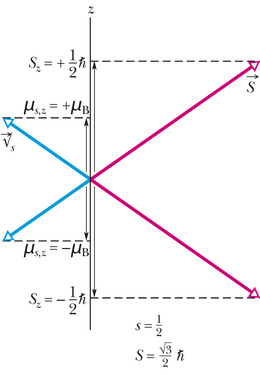
Spinnimpulsimomendi suurusel saab nii vaba kui ka sulustatud elektroni korral olla vaid üks kindel väärtus:
Siin on () elektroni spinnkvantarv ehk spinn.
Nagu märgitud punktis 32-7, on elektronil siseomane magnetiline spinndipoolmoment, mis on seotud selle sisemise spinnimpulsimomendiga (spinnpöörlemishulgaga) avaldise 32-22 kaudu:
Miinusmärk tuleneb vektorite ja vastassuunalisusest. Kuna on kvanditud (vt valem 40-9), peab ka olema kvanditud:
Ei ega pole otseselt mõõdetavad. Kuid mõõta saab nende komponente mistahes telge pidi. Kui võtame teljeks -telje, siis
kus on spinni magnetkvantarv (vt tabel 40-1), millel saab olla vaid kaks väärtust: (tinglikult öeldakse „spinn üles”) ja („spinn alla”).
Kvanditud on ka magnetilise spinndipoolmomendi komponendid :
Joonisel 40-6 on kujutatud spinnimpulsimomendi kaks kvanditud komponenti ning vektori vastavad orientatsioonid. Jooniselt on näha ka magnetilise spinndipoolmomendi komponendid .
Aatomile, milles on üle ühe elektroni, saab defineerida summaarse impulsimomendi . See on üksikelektronide orbitaal- ja spinnimpulsimomentide vektorsumma. Elemendi koha perioodilisussüsteemis määrab prootonite arv selle tuumas: aatomnumber ehk laenguarv . Kuna neutraalses aatomis on prootonitega võrdne arv elektrone, siis kasutame laenguarvu elektronide impulsimomentide summeerimisel ja määratleme järgmiselt:
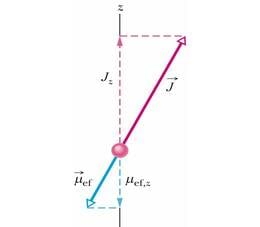
Niisamuti on paljude elektronidega aatomi magnetiline dipoolmoment selle üksikelektronide orbitaalsete magnetiliste dipoolmomentide ja magnetiliste spinndipoolmomentide vektorsumma. Kuid kuna valemis 40-13 (erinevalt valemist 40-5) esineb tegur , siis ei ühti summaarse magnetilise dipoolmomendi suund vektori suunaga, vaid moodustab sellega teatava nurga. Seepärast määratletakse aatomi efektiivne magnetiline dipoolmoment kui üksikute magnetdipoolmomentide vektorsumma komponent sihis (joonis 40-7). Tavaliselt on aatomis enamiku elektronide orbitaal- ja spinnimpulsimomentide vektorsumma null. Siis annavad ja summasse panuse vaid suhteliselt väike arv elektrone, tihti üksainus valentselektron.
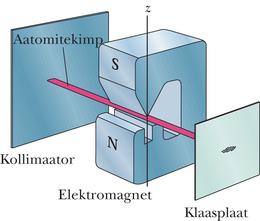
Aastal 1922 näitasid Otto Stern ja Walter Gerlach Hamburgi Ülikoolis katseliselt, et hõbeda aatomite magnetmoment on kvanditud. Katses aurustati hõbe elektriahjus. Ahju seinas oli kitsas pilu, mille kaudu osa auru aatomeid pääses õhutühja torusse. Et aatomitekimpu kitsendada, oli selle teel veel teinegi pilu, kollimaator (joonis 40-8). Kimp juhiti elektromagneti pooluste vahelt läbi ja seejärel sadestus hõbe klaasplaadile.
Kui elektromagnet on sisse lülitamata, sadestub hõbe väikese täpina. Arvutused näitavad, et elektromagneti sisselülitamisel peaks hõbe sadestuma püsttriibuna, sest hõbeda aatomid on magnetdipoolid ja magnetjõud suunavad neid, hälvitades neid veidi üles või alla. Hõbedalaiku analüüsides saab määrata, kui palju aatomid magnetväljas hälbisid. Seejuures tabas Sterni ja Gerlachi üllatus. Enne selle üllatuse ja selle kvantfüüsikaliste järelduste kirjeldust vaatame lähemalt, milline hälvitusjõud aatomitele magnetväljas mõjub.
Sterni ja Gerlachi katses ei mõju liikuvale osakesele tavapärane hälvitusjõud, mida kirjeldab valem 28-2 (), sest aatomid on neutraalsed, . Neile rakendub vastastikmõju magnetvälja ja hõbeda aatomi magnetdipooli vahel. Selle saab arvutada dipooli potentsiaalsest energiast magnetväljas (valem 28-38):
kus on aatomi magnetiline dipoolmoment. Joonisel 40-8 on -telg ja väli suunatud üles. Siis saab valemi 40-15 väljendada aatomi dipoolmomendi projektsiooni kaudu välja suunale:
Kasutame valemit 8-22 () jõu -komponendi leidmiseks:
Seda magnetjõudu, mis hälvitab aatomit magnetvälja läbimisel, me otsimegi.
Tuletis on välja gradient piki -telge. Kui see gradient on null (näiteks homogeenses väljas), siis aatomeid välja läbimisel ei hälvitata. Kirjeldatud katses olid magnetpoolused töödeldud nii, et välja gradient oleks maksimaalne ja aatomite nihe klaasplaadil tuleks selgelt ilmsiks.
Klassikalise füüsika järgi peaks joonisel 40-8 kujutatud magnetvälja läbivate hõbeda aatomite muutuma väärtusest (kui dipoolmoment on suunatud piki -telge otse alla) kuni väärtuseni ( on suunatud piki -telge otse üles). Niisiis peaks valemi 40-17 kohaselt aatomitele mõjuv jõud ja seega ka nende hälve lihtsalt muutuma suurimast allapoole suunatust kuni suurima ülespoole suunatuni ja aatomid peaksid sadestuma klaasile piki püstjoont. Aga nii ei juhtu.
Stern ja Gerlach leidsid, et hõbe sadestus klaasplaadile kahe selgelt eraldunud laiguna, üks ülalpool seda kohta, kuhu aatomid pidanuks langema ilma hälvitamata, ja teine tollest hälvitamata kohast niisama kaugel allpool. Õblukesed hõbedalaigud polnud algul nähtavadki ja katsetulemuse ilmutas õnnelik juhus. Nimelt suitsetas Stern odavat sigarit ja kui ta juhtus hingama plaadile, ühines sigarisuitsus leiduv väävel hõbedaga mustaks hõbesulfiidiks, mis oli hästi nähtav.
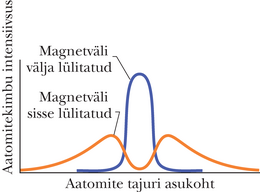
Joonisel 40-9 on hiljem täiuslikuma aparaadiga saadud graafikud. Kasutati tseesiumi aatomeid, mis on samuti magnetdipoolid, ja magnetvälja suurt gradienti . Magnetvälja sai lülitada sisse ja välja ning aatomitekimbus nihutati ülesalla tundlikku aatomite detektorit, mille signaalid ongi joonisel kuvatud.
Kui magnetväli oli välja lülitatud, siis aatomid muidugi ei hälbinud ja detektor registreeris üheainsa laigu nagu näidatud joonisel 40-9. Kui väli oli sisse lülitatud, siis lahknes algne kimp kaheks väiksemaks kimbuks, üks ülalpool ja teine allpool esialgset kimpu. Kui detektorit nihutati vertikaalselt läbi nende kimpude, siis registreeris see kaks eraldiasuvat laiku nagu näidatud joonisel 40-9.
Sterni ja Gerlachi originaalkatses tekkis klaasplaadile kaks hõbedalaiku mitte vertikaalne hõbejälg. Sellest järeldub, et vastupidi klassikalise füüsika ennustusele ei saa magnetmomendi komponendil piki -vektori (ühtlasi -telje) suunda olla mistahes väärtust ja vahemikust. Võimalikud on ainult kaks väärtust, milledest kumbki vastab ühele laigule klaasil. Seega on (siis ka ) kvanditud. Kuna aatomi impulsimoment on magnetmomendiga seotud, peab seegi ja selle komponent olema kvanditud.
Kaasaegsest kvantteooriast teame, et paljuelektronilises hõbeda aatomis on igal elektronil nii orbitaalne kui ka spinnmagnetmoment. Teame ka, et need vektorid summeeruvad nulliks, kui välja arvata üks elektron, mille orbitaalne dipoolmoment on null. Järelikult moodustab aatomi summmaarse magnetmomendi üksnes tolle ühe elektroni spinnmoment. Valemi 40-13 järgi saab projektsioonil piki -telge joonisel 40-8 olla ainult kaks väärtust: üks kvantarvuga („spinn üles”), teine („spinn alla”). Asendus avaldisse 40-13 annab
Edasi, asendades need valemisse 40-17, leiame, et aatomeid magnetväljas hälvitava
jõu komponendil saab olla üksnes kaks väärtust:
Seepärast tekibki klaasile kaks hõbedalaiku.
Näidisülesanne 40-1
Lahendus
JUHTMÕTTED (1) Hälvituse tingib aatomi magnetdipooli ja magnetvälja vastastikmõju gradiendi tõttu. Hälvitusjõud (valem 40-19) mõjub gradiendi (-telje) suunas. Arvutame üksnes hälbe -telje positiivses suunas, s.t on tarvis teada . (2) Eeldame, et välja gradient on ühesugune kogu piirkonnas, mida hõbeda aatomid läbivad. Siis on jõud ja Newtoni teise seaduse järgi ka aatomi kiirendus seal konstantne.
Arvutused: öeldust lähtudes saame kiirenduseks
Et kiirendus on konstantne, võime kasutada valemit 2-15 tabelist 2-1, et arvutada -telje suunaline hälve :
Kuna hälvitusjõud mõjub aatomile risti selle esialgse liikumissuunaga, siis aatomi algkiiruse komponent algses liikumissuunas ei muutu. Aatom vajab aega , et läbida teepikkust selles suunas. Asendame valemis 40-2 aja avaldisega , leiame
Kahe lahknenud kiire nihe on sellest kaks korda suurem: . Vahe on pisike, kuid mõõdetav.
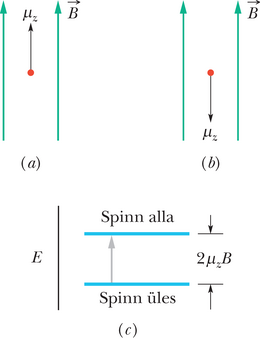
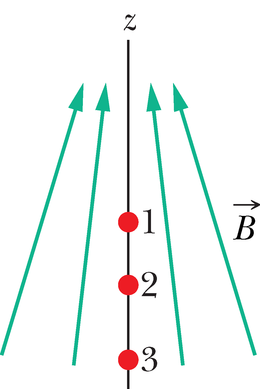
Punktis 32-7 mainisime, et prootonil on magnetiline spinndipoolmoment , mis on seotud selle siseomase spinnimpulsimomendiga . Kuna prooton on positiivse laenguga, on mõlemad vektorid samasuunalised. Kui prooton asub -telje suunalises magnetväljas , siis on vektoril kaks võimalikku orientatsiooni: , kui on väljaga
ühes suunas (joonis 40-10a), või , kui see on vastassuunas (joonis 40-10b).
Valem 28-38 näitab, et magnetdipooli potentsiaalne energia sõltub orientatsioonist väljas nõnda, et energia on seotud kahe vastassuunaga joonisel 40-10. Orientatsioon 40-10a („spinn üles”, , on suunas) on madalama ja orientatsioon 40-10b („spinn alla”, ) kõrgema energiaga. Nende kahe seisundi energiate vahe on
Kui viime ampullitäie vett magnetvälja, siis püüavad vesinikus leiduvad prootonid minna üle madalama energiaga seisundisse. (Hapniku jätame praegu mängust välja.) Iga prooton võib hüpata kõrgema energiaga seisundisse, kui sellele anda footon energiaga
Sellist neeldumist nimetatakse magnetresonantsiks, täpsemalt tuumamagnetresonantsiks (TMR; ingl nuclear magnetic resonance, NMR). Seejuures toimuvat spinni komponendi pööret nimetatakse spinni pöörakuks (ka spinni kummutuseks; ingl spin flip).
Pöörakut tingivad footonid langevad raadiosageduste piirkonda. Raadiosagedus rakendatakse katseobjektile väikese pooli abil, mis on mähitud näidise ümber. Raadiosagedusgeneraator tekitab poolis sinusoidaalse voolu sagedusega . Sama sagedusega võngub muidugi ka elektromagnetväli poolis. Kui rahuldab seost 40-22, siis saab võnkuv väli edastada objektis olevale prootonile energiakvandi, mis põhjustab spinni pööraku.
Magnetväli valemis 40-22 on tegelikult summaarne magnetväli prootoni asukohas. See on katseseadme tekitatud välise välja ja prootoni lähikonnas asuvate aatomite ja tuumade magnetiliste dipoolmomentide tekitatud sisevälja vektorsumma. Tehnilistel põhjustel on mugavam varieerida TMRspektromeetris magnetvälja , jättes raadiosageduse konstantseks. Mõõdetakse raadiogeneraatori energiat. Raadiogeneraatori energiakadude sõltuvus väljast on TMR-spekter. Spektris ilmuvad resonantspiigid neil väärtustel, kus toimub spinni pöörak.
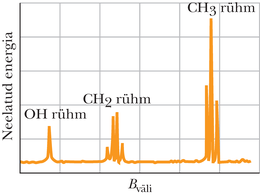
Joonisel 40-11 on etanooli () TMR-spekter. Etanooli molekul koosneb aatomirühmadest , ja . Magnetresonants hõlmab iga rühma prootoneid, kuid igat rühma iseloomustab eri väärtus, sest molekulis ümbritseb igaüht erinev . Seepärast annavad resonantspiigid joonisel 40-11 etanoolile ainuomase spektri - molekuli signatuuri ehk „sõrmejälje”.
Kuna paljudel ainetel on üksnes neile omane TMR-signatuur, siis kasutatakse tuumamagnetresonantsi ainete identifitseerimiseks, näiteks kriminalistikas. Tuleb märkida, et meditsiinilises diagnostikas rakendatakse laialdaselt magnetresonantskuvamist (magnetic resonance imaging, MRI). Inimkeha eri kudedes leiduvad prootonid asuvad erisugustes magnetkeskkondades. Kui keha või kehaosa on viidud tugevasse magnetvälja, saab neid erinevusi TMR järgi tuvastada. Arvutitöötlusega moodustatakse nende erinevuste järgi kujutis, mis meenutab röntgenkiirte abil saadud kujutisi. Joonis 40-12 esitab selle tehnika kasutusnäite 40-6 | Magnetresonants paleontoloogias.
Näidisülesanne 40-2
Lahendus
JUHTMÕTTED (1) Kui prooton asub välises magnetväljas , on sel oma magnetilise dipoolmomendi tõttu potentsiaalne energia. (2) Sellel potentsiaalsel energial saab olla vaid kaks väärtust, väärtuste vahega . (3) Kui prooton läheb ühelt neist energiatest teisele (spinni pöörak), peab valemi 40-22 kohaselt footoni energia olema võrdne selle energiavahega .
Arvutused: asendame valemis 40-22 , leiame
See on spinni pöörakuprotsessis neelatud footonite sagedus; see peab olema ka raadiogeneraatori sagedus ja samuti ka genereeritud elektromagnetvälja sagedus. Nende footonite lainepikkus on
See sagedus on FM-raadio lainealas.
Eelmises, 39. peatükis, käsitlesime elektronide mitmesuguseid püüniseid, alates fiktiivsetest ühemõõtmelistest ja lõpetades kolmemõõtmelise reaalse vesiniku aatomiga. Kõigisse neisse sulustasime üheainsa elektroni. Enne, kui asuda tutvuma lõksudega, millesse on püütud mitu elektroni, peame omandama printsiibi, mis kehtib kõikide osakeste kohta, millede spinnkvantarv s ei võrdu nulli ega ka mõne täisarvuga. See ei kehti üksnes elektronide, vaid ka prootonite ja neutronite kohta, milledel kõikidel on . Printsiibi püstitas 1925. aastal Wolfgang Pauli ja seda tuntakse Pauli keeluprintsiibina ehk välistusprintsiibina. Elektronide kohta kõlab see nii:
Sellest printsiibist järeldub, et aatomis ei saa olla kahte elektroni, mille nelja kvantarvu väärtused , , ja oleksid ühed ja samad. Vähemalt üks neljast peab olema erinev. Kuid kõikidel elektronidel on üks ja sama spinnkvantarv . Kui see nii ei oleks, tabaks aatomeid kollaps ja ei meid teiega ega ka kogu maailma poleks olemas.
Sissejuhatuseks vaatame kaht elektroni nelinurkses püünises, mida kirjeldati 39. peatükis. Lisaks seal sissetoodud kvantarvudele arvestame nüüd ka kummagi elektroni spinnimpulsimomente. Oletame, et püünis asub homogeenses magnetväljas. Siis, vastavalt valemile 40-12 (), võib elektron olla kas seisundis või , vastavalt või . (Eeldame, et väli on nii nõrk, et me ei pruugi väljast tingitud potentsiaalset energiat arvesse võtta.)
Elektrone püünistesse paigutades peame arvestama Pauli keeluprintsiipi: elektronidel ei tohi olla ühesugused kvantarvude komplektid.
- Ühemõõtmeline püünis (joonis 39-2). Elektroni seisundi potentsiaaliaugus laiusega määrab üksainuke kvantarv . Seega peab sulustatud elektron olema olekus, millel on teatud kvantarv ja võib olla kas või . Kahel elektronil võib olla kas sama ja erinev või sama ja erinev .
- Ristkülikukujuline koppel (joonis 39-13). Et sobitada elektroni lainet mõõtmetega ja , on vaja kahte kvantarvu ja ; võib olla , kokku on siis vaja kolme kvantarvu. Pauli printsiibi järgi peab kummalgi elektronil vähemasti üks kvantarv kolmest olema erinev.
- Risttahukas (joonis 39-14). Kolme mõõtmega , ja sobitamiseks kulub kolm kvantarvu , ja nz, ja , kokku siis neli kvantarvu. Vähemalt üks kolmest peab iga elektroni puhul olema erinev.
Kujutleme, et paneme eelloetletud püünistesse rohkem kui kaks elektroni. Esimesed elektronid hõivavad muidugi madalaimad energiatasemed. Kuid Pauli keeluprintsiip piirab nende arvu. Mis üle lubatu, peavad hõivama juba kõrgemad tasemed. Öeldakse, et madalaim tase on täis ehk täielikult hõivatud. Kui mingil tasemel pole ühtki elektroni, siis on see tühi ehk hõivamata. Vahepealseil juhtudel võib tase olla osaliselt hõivatud. Sulustatud elektronide süsteem, elektronkonfiguratsioon, on esitatav kas tasemete skeemi või kvantarvude
loeteludena.
Seame eesmärgiks leida kahe või enama sulustatud elektroni süsteemi summaarse energia iga konfiguratsiooni jaoks.
Lihtsustuseks eeldame, et elektronide vahel pole elektrilist vastastikmõju, s.t jätame arvestamata elektronpaaride potentsiaalse energia. Niisiis, arvutame iga konfiguratsiooni summaarse energia, leides iga elektroni energia eraldi, nii nagu tegime 39. peatükis. Lõpuks liidame leitud energiad. Niiviisi teeme näidisülesandes 40-3 arvutused seitsme elektroni kohta, mis on sulustatud ruudukujulisse koplisse.
Sobiv on näitlikult esitada süsteemi energiad tasemete diagrammil, nii nagu tegime varem ainsa elektroni jaoks. Madalaim tase vastab süsteemi põhitasemele, esimesele ergastustasemele, teisele ergastustasemele ja nõnda edasi.
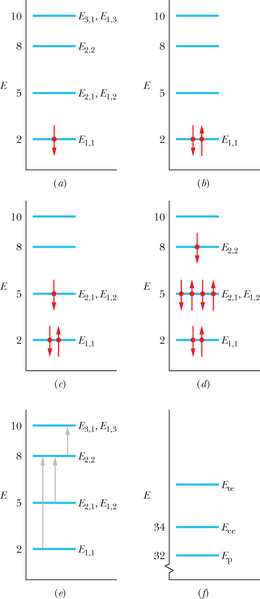
Seitse elektroni on sulustatud ruudukujulisse kvantkoplisse nagu näidisülesandes 39-5, ruudu külgedega Lx=Ly=L (joonis 40-13). Eeldatakse, et elektronide vahel puudub elektriline vastastikmõju.
(a)
Lahendus
Ühe-elektroni-diagramm: võime määrata elektronkonfiguratsiooni, kui paigutame elektrone ühekaupa kvantkoplisse. Kuna me eirame elektronide elektrilist vastastikmõju, võime lähtuda ühe sulustatud elektroni energiatasemete skeemist, mis on toodud joonisel 39-15 ja osaliselt reprodutseeritud joonisel 40-13a. Meenutame, et tasemed on märgistatud kujul . Näiteks on madalaim tase E1,1 ( ja ).
Pauli printsiip: ühelgi sulustatud elektronil ei tohi olla teistega kokkulangevat kvantarvude , ja komplekti. Esimene elektron läheb madalaimale tasemele E1,1 ja tal võib olla või . Valime (meelevaldselt) teise võimaluse ja märgime tasemele E1,1 joonisel 40-13a. Samale tasemele „mahub” veel teinegi elektron, kuid sellel peab , mida joonisel 40-13b tähistab tasemel E1,1.
Lükime elektrone ühekaupa juurde: esimene tase on nüüd täis, kolmas elektron peab minema kidunud tasemele kvantarvudega ja , või ja . Sellelgi võib olla või . Omistame sellele , ja ning märgime tasemele joonisel 40-13c. Samale tasemele mahuvad ka järgmised kolm elektroni tingimusel, et komplekt (, , ) ei oma duplikaati. Tasemel on siis kokku neli elektroni kvantarvude kogumitega
ja tase on nüüd täis. Järgmine elektron peab asuma järgmisele kõrgemale tasemele . Olgu selle spinn .
Joonis 40-13d näitab kõiki seitset elektroni üheelektroni- energiatasemete pildil. See on madalaima energiaga konfiguratsioon, mis rahuldab Pauli keeluprintsiipi. Sama põhioleku konfiguratsioon on koondatud tabelisse 40-2.
(b)
Lahendus
JUHTMÕTE Koguenergia süsteemi põhiolekus võrdub üksikelektronide energiate summaga süsteemi põhioleku konfiguratsioonis.
Põhioleku energia: iga elektroni energia leiame tabelist 39-1, mis on osaliselt reprodutseeritud tabelis 40-2, või siis näeme seda joonisel 40-13d. Kuna madalaimal tasemel on kaks elektroni, järgmisel neli ja kolmandal üks, saame
(c)
Lahendus
JUHTMÕTTED (1) Et süsteemi ergastada, peab üks seitsmest elektronist sooritama kvanthüppe üles energiatasemete skeemil joonisel 40-13d. (2) Võimaldamaks hüpet, peab elektroni (ja seega kogu süsteemi) energiamuut olema , kus on hüppe lähtetaseme ja lõpptaseme energia. (3) Arvestada tuleb Pauli keeluprintsiipi. Näiteks ei saa elektron hüpata täielikult hõivatud tasemele.
Esimese ergastustaseme energia: käsitleme kolme hüpet joonisel 40-13e. Kõiki neid lubab Pauli printsiip, sest need lõppevad tühjadel või osaliselt hõivatud tasemetel. Ühel näidatuist hüppab elektron E1,1 tasemelt osaliselt täidetud tasemele . Energiamuut on
(Eeldame, et hüppava elektroni spinni orientatsioon muutub nii, kuidas tarvis.)
Teisel võimalikul hüppel siirdub elektron kidunud tasemelt ja osaliselt hõivatud tasemele . Energiamuut on
Kolmandal juhul toimub hüpe , . Energiamuut on
Neist kolmest kvantsiirdest nõuab viimane kõige vähem energiat. Võime vaadata veel teisigi võimalikke hüppeid, kuid ükski neist ei tarbi vähem energiat. Seega selle süsteemi viib põhiolekust esimesse ergastatud olekusse kvanthüpe , ja vajalik energiahulk
Seega on süsteemi esimese ergastusoleku energia
Selle energia ja põhioleku energia võime esitada tasemete diagrammil süsteemi jaoks nagu näidatud joonisel 40-13f.
Neli kvantarvu , , ja ms identifitseerivad üksikelektronide kvantseisundeid paljude elektronidega aatomis. Kummatigi pole nende seisundite lainefunktsioonid samasugused kui vesiniku aatomite lainefunktsioonid vastavates olekutes, sest mitmeelektronilises aatomis ei määra elektroni potentsiaalset energiat üksnes tuuma laeng ja asend, vaid ka aatomi kõikide teiste elektronide laengud ja asukohad. Paljuelektroniliste aatomite Schrödingeri võrrandit saab lahendada numbriliselt arvuti abil, vähemasti põhimõtteliselt.
Punktides 39-9 ja 40-3 määratlesime, et kõik seisundid, millede kvantarvud ja ühtivad, moodustavad alamkihi. Iga kvantarvu väärtuse korral on 2ℓ+1 võimalikku magnetkvantarvu väärtust ja iga kohta tuleb kaks spinnkvantarvu väärtust. Seega on alamkihis seisundit. Kõigil teatava alamkihi seisunditel on üks ja sama energia. Selle suuruse määrab eeskätt arv , väiksemal määral .
Et alamkihte mugavamalt tähistada, on kokku lepitud tähistada väärtusi tähtedega:
Näiteks tähendab alamkiht alamkihti, mille n=3 ja ℓ=2.
Jagades elektrone paljuelektronilises aatomis alamkihtidesse tuleb muidugi arvestada Pauli keeluprintsiipi (punkt 40-7), mis nõuab, et kahel elektronil aatomis ei või olla ühesugune kvantarvude , , ja ms komplekt. Kui see ülitähtis printsiip ei kehtiks, siis langeksid kõik elektronid madalaima energiaga olekusse. Ei saaks tekkida erinevaid aatomeid ja molekule, poleks olemas ei keemiat ega biokeemiat ning poleks ka meid teiega. Järgnevalt vaatame mõningate elementide aatomeid, et näha, kuidas Pauli printsiip toimib elementide perioodilisussüsteemi koostamisel.
Neooni aatomis on elektroni. Ainult kaks neist asetub madalaima energiaga 1s alamkihti. Mõlemal on ja , , kuid ühel neist on ja teisel . 1s alamkiht sisaldab seisundit. Kuna sellesse alamkihti Pauli printsiibi järgi rohkem elektrone ei mahu, on see täidetud alamkiht.
Kaks ülejäänud kaheksast elektronist hõivavad järgmise madalaima energiaga alamkihi. Jääb elektroni, mis asuvad alamkihti (ℓ=1), kuhu mahub elektroni.
Täidetud alamkihis esinevad kõikvõimalikud impulsimomendi projektsioonid -teljele. Nagu võib kontrollida jooniselt 40-5, on need projektsioonivektorid vastassuunalised ja kompenseeruvad vastastikku. Kompenseeruvad ka kõik spinnimpulsimomendi projektsioonid. Seega pole täidetud alamkihil ei impulsimomenti ega ka magnetmomenti. Alamkihi tõenäosustihedus on kerasümmeetriline. Üheski kolmest täidetud alamkihist (1s, ja ) pole „ripakil” elektrone, mis võiksid teiste aatomitega keemilisi sidemeid moodustada. Seepärast on neoon, nagu ka teisedki perioodilisustabeli äärmisse parempoolsesse tulpa kuuluvad väärisgaasid ehk inertgaasid, keemiliselt inertsed.
Neoonile järgneb perioodilisussüsteemis naatrium oma elektroniga. Kümme neist moodustavad täidetud neoonilaadse südamiku, mille impulsimoment on . Ainus väljapoole jääv elektron, valentselektron, jääb sellest südamikust kaugele, energeetiliselt järgmisesse alamkihti. Kuna -kihis on orbitaalne impulsimoment null, siis annab naatriumi aatomi impulsimomendi ja magnetmomendi tervenisti valentselektroni spinn.
Tänu sellele „ripakil” elektronile ühineb naatrium hõlpsasti teiste aatomitega, millede elektronkattes on tühik, kuhu valentselektron sobib. Seepärast on naatrium, nagu ka teisedki perioodilisustabeli vasakpoolse tulba elemendid ehk leelismetallid, keemiliselt aktiivne.
Kloori aatomis on 17 elektroni. Sel on -elektroniline neoonilaadne täidetud südamik. Üle jääb elektroni. Kaks neist täidab alamkihi, viis jääb järgmisse, 3p alamkihti. Kuna sellesse mahuks elektroni, siis jääb sinna üks tühik.
Nõnda seostub kloor meelsasti teiste aatomitega, milledel on valentselektron, mis kõlbab selle tühiku täiteks. Näiteks on keedusool väga püsiv ühend. Kloor, nagu ka teisedki perioodilisustabeli VIIA veergu langevad halogeenid, on keemiliselt aktiivne.
Raua aatomi elektroni paigutust alamkihtidesse saab esitada niiviisi:
Alamkihid on järjestatud kvantarvude kasvu kohaselt. Ülaindeks, nagu tavaks, tähistab elektronide arvu alamkihis. Tabelist 40-1 on näha, et -alamkiht () mahutab elektroni, -alamkiht (ℓ=1) võtab vastu ja -alamkiht (ℓ=2) elektroni. Niisiis moodustavad raua esimest elektroni viis täidetud alamkihti (neid märgistab allakriipsutus). Tuleb veel leida koht kaheksale elektronile. Kuus neist asub alamkihti, ülejäänud kaks alamkihti.
Miks ei asetu ka viimased kaks elektroni alamkihti? „Ruumi” ju neile seal jätkuks. Põhjus on selles, et konfiguratsioon tagab aatomile tervikuna madalama energia kui konfiguratsioon . Kui elektronid paigutunukski kõik -kihti, toimuks kähku siire koos vastava energiaga footoni kiirgumisega. Siit võib õppida seda, et kui lihtsaimad aatomid välja arvata, siis ei täitu seisundid mõnikord nii, nagu nende loogiline järjekord näib dikteerivat.
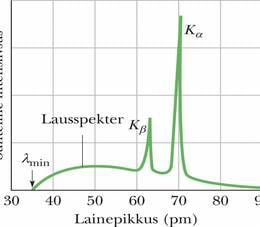
Kui tahkismärklauda (näiteks vaske või volframit) pommitada elektronidega, mille energia on kiloelektronvoltide suurusjärgus, siis tekib lühilaineline elektromagnetkiirgus – röntgenkiirgus. Selle kiirguse paljud rakendused meditsiinis ning tehnikas on hästi tuntud. Järgnevalt selgitame, mida võib röntgenkiirtest välja lugeda aatomite kohta, mis neid neelavad või kiirgavad. Joonisel 40-14 on molübdeenile langevate energiaga elektronide tekitatud röntgenkiirte spekter. Näeme laia lausspektrit, millest ulatub välja kaks teravat piiki. Pidev lausspekter ja piigid tekivad eri mehhanismide läbi. Käsitleme neid eraldi.
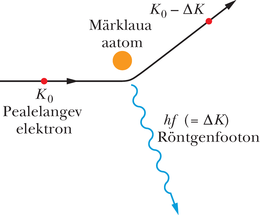
Põrkugu kineetilise algenergiaga elektron ühega märklaua aatomitest (joonis 40-15). Elektron võib kaotada energiahulga , mis muundub põrkepunktist kiirguvaks röntgenfootoniks. (Me ei arvesta siin tühist energiahulka, mis antakse põrkel aatomile, sest aatomi mass on suhteliselt suur.)
Hajutatud elektron (joonis 40-15), mille energia on nüüd juba väiksem kui , võib uuesti põrkuda mõne aatomiga, tekitades uue, erineva energiaga footoni. See protsess jätkub seni, kuni elektron jääb peaaegu paigale. Kõik põrgetel genereeritud footonid lisanduvad lausspektrisse.
Selle spektri oluline erisus on piirlainepikkus , millest lühemaid laineid ei tekitata. See minimaalne lainepikkus vastab põrkele, milles elektron kaotab kogu oma algse kineetilise energia lauppõrkes aatomiga. Vastav minimaalne lainepikkus väljendub seosest
ehk
See lainepikkus ei sõltu üldse märklaua materjalist. Kui näiteks vahetada molübdeenist märklaud vasest märklauaga, muutuks kogu spekter, ainult piirlainepikkus jääks samaks.
Näidisülesanne 40-4
Lahendus
JUHTMÕTE Piirlainepikkus vastab elektronile, mis edastab (ligikaudselt) kogu oma energia röntgenfootonile ja seetõttu on footonil suurim võimalik sagedus ja minimaalne lainepikkus.
Arvutus: valemi 40-23 järgi
Pöörame nüüd tähelepanu piikidele ja joonisel 40-14. Need (ja teised jooniselt välja jäänud piigid) moodustavad märklaua materjali röntgenkiirte karakteristliku spektri.
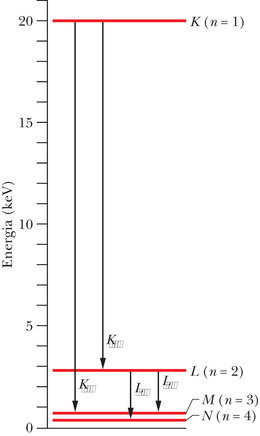
Piigid tekivad kaheastmelise protsessi kaudu. (1) Elektron põrkub ühega märklaua aatomitest ja hajub sellelt, lüües aatomist välja ühe sügavama elektronkihi ( väikese väärtusega) elektroni. Kui see süvaelektron juhtub olema kihis, mille (seda kihti kutsutakse ajaloolistel põhjustel -kihiks), jääb kihti tühi koht ehk „auk”. (2) Üks elektronidest suurema energiaga kihist siirdub -kihti ja täidab selle augu. Sel siirdel kiirgab aatom karakteristliku röntgenfootoni. Kui elektron tuleb kihist, mille (nn -kihist), siis tekib -joon; kui see tuleb kihist n=3 (nn -kihist), ilmneb -joon ja nõnda edasi. - või -kihti jääv auk täidetakse elektroniga mõnest tuumast kaugemast kihist.
Röntgenspektrite uurimisel on elektronide hüpete asemel kohasem jälgida augu asendit aatomi elektronpilves. Sedaviisi on joonestatud ka molübdeeni energiatasemete ja siirete skeem joonisel 40-16. Alusjoon vastab neutraalse aatomi põhiolekule. -tase vastab molübdeenile auguga -kihis, – -kihis jne.
Noolte , tähistus joonisel 40-16 vastab spektrijoonte tähistusele joonisel
40-14. Näiteks joon tekib, kui -kihi elektron täidab augu -kihis. -ga tähistatud nool vastab -kihi augu siirdumisele -kihti.
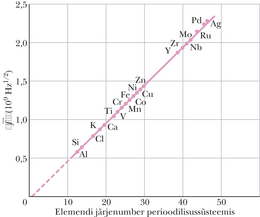
Aastal 1913 tekitas Briti füüsik H. G. J. Moseley karakteristlikke röntgenkiiri 38 elemendist, mis talle sel ajal kättesaadavad olid. Ta ehitas röntgentoru, milles sai eri aineist märklaudu järjestikku nihutada elektronkimpu ilma toru avamata. Röntgenkiirte lainepikkuse määras ta punktis 36-10 kirjeldatud difraktsioonmeetodil, kasutades kristalle difraktsioonivõredena.
Nihutades ette järjest uusi elemente, otsis ja leidis Moseley saadud spektreis seaduspärasust. Ta tuvastas, et kui ta kandis graafikule näiteks -joonele vastava sageduse ruutjuure sõltuvuse elemendi järjenumbrist perioodilisussüsteemis, siis langesid punktid sirgele (joonis 40-17). Moseley tegi järelduse:
„Oleme näidanud, et aatomil on mingi siseomadus, mis kasvab korrapäraste astmete kaupa, kui liigume ühelt elemendilt järgmisele. See omadus saab olla ainult selle keskel asuva tuuma laeng.”
Moseley uurimuse järel sai hakata karakteristlikku röntgenspektrit käsitlema elemendi signatuurina. Nüüd oli võimalik lahendada mitmed perioodilisustabeli mõistatused. Varem määrati elemendi asukoht tabelis selle aatomi massi järgi, kuid mitme elemendipaari puhul tuli järjestust muuta, sest seda nõudsid ilmsed keemilised tõigad. Moseley näitas, et elementide õigeks järjestamiseks tuleb aluseks võtta tuumalaeng (aatomnumber ). Aastal 1913, enne Moseley tööd, oli perioodilisustabelis mitmeid tühje lahtreid. Ennustati hulgiti uusi elemente. Röntgenspekter andis sellistele ennustustele usaldusväärse kontrollvõimaluse. Lantaniidide hulka kuuluvate elementide (vahel nimetatud ka haruldasteks muldmetallideks) liigitamises oli tublisti segadust, sest nende keemilised omadused on üpris sarnased. Alles Moseley metoodika lubas need õigesti paika panna.
Pole raske mõista, miks elementide karakteristlikud röntgenspekterid reastuvad range regulaarsusega nagu joonisel 40-17, nähtava kiirguse spektrid (optilised spektrid) aga mitte. Elemendi määrab ära selle tuumalaeng. Näiteks iseloomustab kulda tuumalaeng (). Kui tuumalaeng on ühe võrra suurem, on juba tegemist elavhõbedaga, kui ühe võrra väiksem, siis plaatinaga. -kihi elektronid, mis määravad oluliselt karakteristliku röntgenspektri väljanägemise, asuvad tuuma lähedal ja on seepärast selle laengu tundlikuks näitajaks. Seevastu optiline spekter tekib väliselektronidevahelistel siiretel. Need on vahepealsete elektronkihtide poolt tuumast eraldatud ja ei ole seepärast tuumalaengu indikaatoriteks.
Moseley eksperimentaalandmeid saaks kasutada elementide korrektseks paigutamiseks perioodilisustabelisse isegi siis, kui selleks puuduks teoreetiline alus. Kummatigi on selline alus olemas.
Vastavalt valemeile 39-32 ja 39-33 on vesiniku aatomi energia
Vaatame nüüd üht paljuelektronilise aatomi -kihi elektroni. Kuna aatomis on veel teinegi -kihi elektron, siis „tunnetab” vaatlusalune elektron efektiivset tuumalaengut ligikaudse suurusega ; kus on elementaarlaeng ja elemendi aatomnumber. Tegur valemis 40-24 on vesiniku tuumalaengu ruudu ja elektroni laengu ruudu korrutis . Paljuelektronilise aatomi korral võime arvutada aatomi efektiivset energiat, kui asendame teguri korrutisega ehk teguriga . Saame
Nägime, et -footon tekib, kui elektron siirdub -kihist (, ) -kihti (, ). Siis saame valemi 40-25 järgi energiamuudu
Võttes mõlemast poolest ruutjuure, saame
kus konstant . Avaldis 40-27 on sirge võrrand. Just see oligi Moseley tulemus (vt joonis 40-17).
Näidisülesanne 40-5
Lahendus
JUHTMÕTE Nii koobalti () kui ka lisandi () Ka-joonte lainepikkused langevad Ka Moseley sirgele, mille võrrand on 40-27.
Arvutus: asendades valemis 40-27, saame
Elimineerime jagades esimese võrrandi teisega, saame
Paneme sisse algandmed, saame
Lahendame tundmatu suhtes. Leiame, et
Pilk perioodilisussüsteemi tabelile näitab sedamaid, et lisandiks on tsink. Paneme tähele, et kuna tsingi aatomnumber on koobalti omast suurem, on tsingi -joone
lainepikkus väiksem.
1960ndate aastate alguses andis kvantfüüsika ühe oma olulisima panuse tehnikasse: loodi laserid. Nagu tavalise lambi valguski, tekib laserivalgus siis, kui aatomid siirduvad kõrgema energiaga kvantseisundist madalama energiaga olekusse. Kuid laseris on siirded kooskõlastatud. See tingib laserivalguse järgmised eripärad:
- Laserivalgus on ülimalt monokroomaatne. Tavalise elektripirni valgus langeb laia lausspektrisse ja pole üldse monokroomaatne. Tõsi, neoonreklaami valguski on monokroomaatne, kiirgub kitsukesse spektriribasse, mis moodustab nähtavast spektrist, kuid laserist kiiratu on veelgi kitsamas sagedusribas, mille täpsus on .
- Laserivalgus on ülimalt koherentne. Laserist tulevad üksikud lainerodud (lainepaketid, ingl wave trains) võivad olla kilomeetrite pikkused. Kui kaks eraldi kiirt, mis on läbinud nii pikki vahemaid, uuesti kokku juhtida, „mäletavad” need oma ühist päritolu ja võivad moodustada interferentsimustri. Vastav koherentsuspikkus on tavalise elektripirni korral vähem kui meeter.
- Laserivalgus on ülimalt suunatud. Laseri kiirtekimp ei lahkne pea üldse; see hälbib rangest paralleelsusest üksnes difraktsiooni tõttu laseri väljundaval. Kui näiteks laserikiir suunati Kuule, et mõõta kaugust Maast Kuuni, tekitas see Kuu pinnal vaid mõnemeetrise läbimõõduga valguslaigu. Ka elektripirni valgust võib koondada läätsede abil ligikaudu paralleelseks kimbuks, kuid see lahkneb siiski laserikiirest palju rohkem. Iga punkt pirni hõõgniidist kiirgab eraldi kiirt ja kogu valgusvihu lahknevuse määravad hõõgniidi mõõtmed.
- Laserivalgust saab teravustada üliväikeseks täpiks. Kui kaks valguskiirt kannavad edasi ühesugust energiahulka, siis kiir, mida saab teravustada väiksemaks täpiks, annab täpile suurema heleduse. Laserivalgust saab fokuseerida nii pisikeseks täpiks, et võib kergesti saavutada täpi intensiivsuse . Võrdluseks: atsetüleenhapnikleegi intensiivsus on vaid .
Kõige pisemad laserid, mida kasutatakse heli jm teabe ülekandmiseks kiudoptiliste juhtmete kaudu, on vaid nõelapea suurused. Isegi nii tillukesed laserid võivad olla võimsusega . Suurimad laserid, mida rakendatakse termotuumasünteesi uuringutes, astronoomilistes kaugusmõõtmistes ning sõjanduses, täidavad terve hoone. Suurimad sedalaadi laserid võivad genereerida lühikesi laserivälkeid, millede võimsus on . See ületab mõnisada korda Ameerika Ühendriikide kõikide elektrijaamade summaarse võimsuse. Et välgatuse ajal ei kustuks kogu riigis valgus, kogutakse nende pikal vaheajal energiat spetsiaalsetesse akumulaatoritesse.
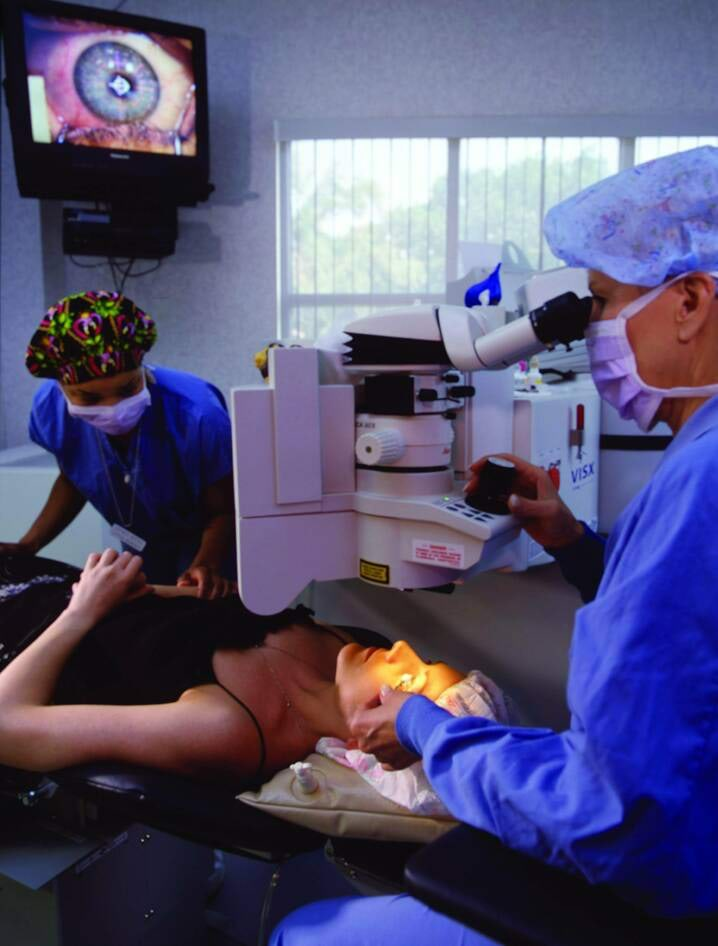
Laserite mitmekesistest rakendustest võiks nimetada vöötkoodi lugejaid kaubamajades, laserplaatide (CD, DVD, BD) valmistamist ja mahamängimist, mitmesuguseid kirurgilisi operatsioone (vt selle peatüki avafotot ja joonist 40-18), maamõõdistust, kangaste juurdelõikust (mitmesajakihilisest kangapaketist), autokerede keevitamist, hologrammide valmistamist.
Sõna „laser” on lühendsõna, akronüüm ingliskeelsest sõnaühendist
Light
Amplification by
Stimulated
Emission of
Radiation
(Valguse võimendumine stimuleeritud kiirguse kaudu.)
Nagu nimetusestki näha, on stimuleeritud kiirgus laserite funktsioneerimise alus. Stimuleeritud kiirguse mõiste tõi aastal 1917. aastal sisse Albert Einstein. Kuigi maailm pidi ootama 1960. aastani, et näha esimest laserit kiirgamas, oli selle alus rajatud aastakümneid varem.
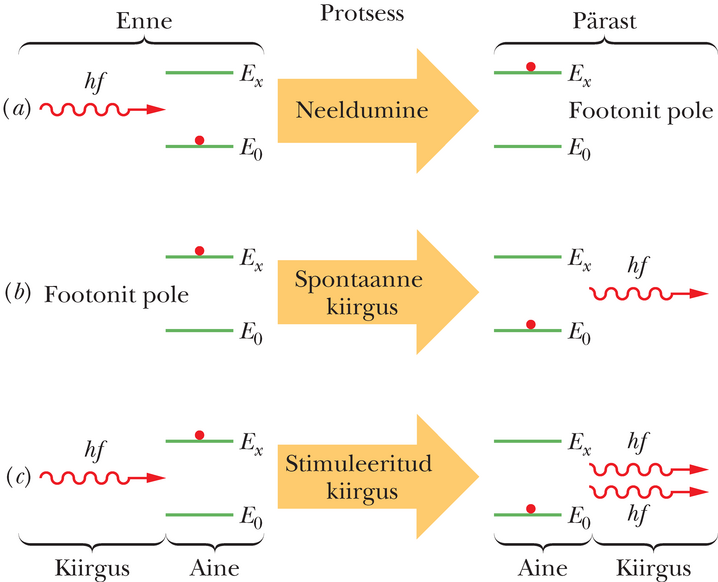
Võtame vaatluse alla isoleeritud aatomi, mis võib eksisteerida kas oma madalaimas, põhiolekus energiaga või kõrgemas, ergastatud seisundis energiaga . On kolm protsessi, mille kaudu aatom võib neid olekuid vahetada:
- Neeldumine. Joonisel 40-19a on aatom algul põhiolekus. Kui aatom on asetatud elektromagnetvälja, mis võngub sagedusega , võib aatom neelata väljast energiakvandi ja tõusta kõrgema energiaga seisundisse. Energia jäävusest järeldub, et
See protsess on neeldumine.
- Spontaanne ehk vabakiirgus. Joonisel 40-19b on aatom ergastatud olekus. Väline kiirgus puudub. Hetke pärast siirdub see iseenesest põhiolekusse, kiirates footoni energiaga . See on spontaanne kiirgus – spontaanne (ld spontaneus – isetekkeline), sest sündmust ei vallandanud mingi väline mõjur. Tavalise elektripirni valgus tekib just sel moel. Tavaliselt on ergastatud aatomis ergastuse keskmine püsimisaeg ehk ergastuse keskmine eluiga suurusjärgus . Kuid mõnedel ergastusseisunditel on eluiga isegi kuni korda pikem. Selliseid seisundeid nimetatakse metastabiilseteks; laserites mängivad need seisundid olulist osa.
- Stimuleeritud ehk indutseeritud kiirgus. Joonisel 40-19c on aatom taas ergastusseisundis. Kuid nüüd on olemas ka kiirgus valemiga 40-28 määratud sagedusel. Footon energiaga saab sundida, stimuleerida (ld stimulare – ergutama, virgutama; stimulus – astel, kepp, näiteks eesliajaja sunniriist) aatomit kiirgama lisafootonit, mille energia on samuti . See protsess kannab stimuleeritud kiirguse nime; stimuleeritud, sest kiirgumise ajendab väline footon. Kiiratud footon on igapidi sarnane stimuleerivaga. Kummagi footoniga kaasnevad valguslained on ühisfaasis, neil on sama polarisatsioon ja need kulgevad samas suunas. Joonis 40-19c näitlikustab üksikaatomi stimuleeritud kiirgust.
Kujutleme nüüd, et meil on koos suur arv aatomeid, mis on soojuslikus tasakaalus temperatuuril . Olgu neid põhiolekus energiaga ja ergastatud olekus energiaga . Ludwig Boltzmann andis valemi, mis kirjeldab aatomite jaotumist energiatasemetel:
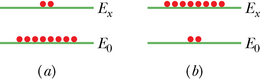
kus on Boltzmanni konstant. Valem näib intuitiivseltki igati mõistlik. Korrutis kT on aatomi keskmine kineetiline energia temperatuuril . Mida kõrgem temperatuur, seda enam aatomeid heidetakse soojusergastuse (s.t aatomite vaheliste põrgete) toimel kõrgema energiaga seisundisse . Kuna , siis on valemi kohaselt : ergastatud olekus on alati vähem aatomeid kui põhiolekus. Skemaatiliselt näitab seda soojusliku tasakaalu seisundit joonis 40-20a.
Kui nüüd kiiritada joonisel 40-20a kujutatud aatomeid footonitega, millede energia on , siis neelavad põhiseisundis olevad aatomid ohtrasti footoneid. Mõnevõrra need genereerivad ka uusi footoneid, stimuleerides väheste ergastatud aatomite kiirgust. Einstein näitas, et mõlema protsessi tõenäosused aatomi kohta on võrdsed. Kuna põhiseisundis on aatomeid rohkem, on neeldumine ülekaalus.
Et genereerida laserivalgust, peab stimuleeritud kiirgus olema ülekaalus. Selleks peab lähtuma seisundist, milles ergastatud aatomite hulk ületab põhiseisundis olevate hulga (joonis 40-20b). Sellist seisundit nimetatakse pöördhõiveks ehk populatsiooni inversiooniks. Kuna leidsime, et seda pole võimalik saavutada soojusergastuse teel, tuleb selleks leiutada kavalaid kaudteid.
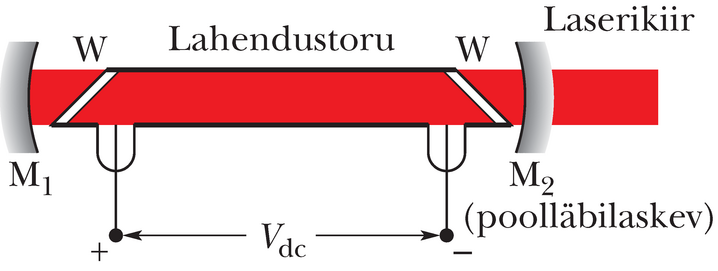
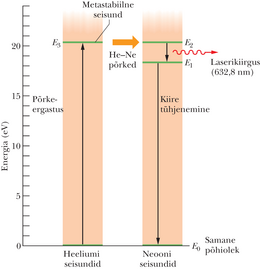
Joonisel 40-21 on heeliumi ja neooni segul töötav laser. See laseritüüp on levinuim üliõpilaste praktikumides. Selle laseri leiutas aastal 1961 Ali Javan koos oma töökaaslastega. Laseri klaastorus on heeliumi ja neooni segu vahekorras . Laserikiirgust eritab neoon.
Joonisel 40-22 on kummagi gaasi aatomite energiatasemete lihtsustatud skeem. Lahendustorus tekitatakse elektrivool ja selles kihutavad elektronid ergastavad põrgetel heeliumiaatomeid hulgiti metastabiilsele tasemele .
Heeliumi seisundi energia () on väga lähedane neooni taseme energiale (). Kui metastabiilne () heeliumi aatom põrkub põhiseisundis () oleva neooni aatomiga kokku, kandub heeliumi ergastusenergia tasemete ligiduse tõttu hõlpsasti neooni aatomile, mis tõuseb olekusse . Niiviisi saavutatakse pöördhõive: neooni taseme asustatus ületab taseme hõivet.
Pöördhõivet on suhteliselt lihtne saavutada, sest (1) algselt puuduvad neooni aatomid olekus ; (2) heeliumi taseme metastabiilsus tagab seisundis olevate neooni aatomite ohtra varu ja (3) neooni tase tühjeneb nobedasti neooni põhiolekusse (joonisel märkimata vahetasemete kaudu).
Kui neooni aatomi spontaansel siirdel kiiratakse footon, vallandab see
stimuleeritud siirete kaskaadi. Kähku kujuneb laseritoru telge mööda kulgev koherentne punane valgusvoog lainepikkusel . See hakkab pendeldama peeglite ja vahel, ajendades iga käiguga üha uusi stimuleeritud kiirgusakte. Kuna on poolläbipaistev, siis väljub selle kaudu osa valgust, moodustades laseri kiire.
Heelium-neoonlaseris tekib neooni aatomi kahe ergastatud seisundi vahelistel siiretel laserikiir. Paljudes laseritüüpides aga tagavad laseritoime siirded ergastusoleku ja põhioleku vahel, nagu joonisel 40-20b.
(a)
Lahendus
JUHTMÕTTED (1) Asustatuse suhe , mille määrab soojuslik ergastus, on arvutatav valemist 40-29, mille kirjutame ümber kujul
Et siit Nx/N0 leida, tuleb määrata energiate vahe Ex – E0 nende seisundite vahel. (2) Selle saab määrata laserikiirguse lainepikkusest .
Arvutus: laserikiirguse lainepikkusest leiame
Valemi 40-30 kasutamiseks on vaja veel aatomite keskmist soojusenergiat kT toatemperatuuril (300K):
Asetades saadud arvud valemisse 40-30, saame
See on üliväike arv, kuid selle väiksus on igati mõistetav, sest ilmselt ei edasta aatomid keskmise soojusenergiaga just sageli energiahulka põrkel teise aatomiga.
(b)
Lahendus
Arvutus: nüüd tahame teada temperatuuri, millel soojusliikumine on põrgatanud märgatava osa aatomitest kõrgemale energiatasemele. Asendame suhte valemisse 40-30 ja võtame kummastki poolest naturaallogaritmi, leiame :
See on palju kõrgem kui Päikese pinnatemperatuur. Selge siis, et pöördhõive saavutamiseks on vaja mingit erimehhanismi, et aatomeid „üles pumbata”. Soojusliku ergastusega pole pöördhõive saavutatav.
Aatomite mõned omadused
Aatomite energia on kvanditud, eri kvantseisunditele vastavad erinevad energiad. Aatomid võivad siirduda ühest kvantseisundist teise, kiirates või neelates footoni. Vastava footoni sageduse määrab seos
kus on siirdes osaleva kõrgema ja madalama taseme energia. Ka aatomite impulsimomendid ja magnetilised dipoolmomendid on kvanditud.
Impulsimomendid ja magnetilised dipoolmomendid
Aatomisse sulustatud elektronil on orbitaalne impulsimoment , mille suurus avaldub valemiga
kus on orbitaalkvantarv (võib omandada tabelis 40-1 esitatud väärtusi) ja konstant . Vektori projektsioon suvalisele z-teljele on kvanditud; see on mõõdetav ja võib omandada väärtusi
kus on orbitaalne magnetkvantarv (võimalikud väärtused on toodud tabelis 40-1). Elektroni impulsimomendiga on seotud orbitaalne magnetiline dipoolmoment , mis on vektoriga vastassuunaline.
kus miinusmärk vihjab vastassuunalisusele. Vektori projektsioon z-teljele on kvanditud, mõõdetav ja võib omandada väärtusi
Elektronil, olgu see siis sulustatud või vaba, on spinnimpulsimoment (ehk lihtsalt spinn) , mille suuruse annab valem
kus on elektroni spinnkvantarv, mis on alati . Vektori projektsioon suvalisele z-teljele on kvanditud, mõõdetav ja omandab väärtusi
kus on elektroni spinnmagnetkvantarv, kas või . Nii vabal kui ka sulustatud elektronil on spinnimpulsimomendiga seotud siseomane magnetdipool magnetiline spinndipoolmomendiga , mis on vektoriga vastassuunaline:
Vektori projektsioon suvalisele z-teljele on kvanditud, mõõdetav ja väärtustega
Spinn ja magnetresonants
Prootonil on siseomane spinnimpulsimoment ja sellega seotud magnetiline spinndipoolmoment, mis on alati spinnimpulsimomendiga samasuunaline. Kui prooton asub magnetväljas , siis vektori projektsioon z-teljele (mis suunatakse piki suunda) omandab üksnes kaks kvanditud väärtust: väljaga samasuunaline ja vastassuunaline. Energiavahe nende orientatsioonide vahel on . Et pöörata spinni ühest orientatsioonist teise (spinni pöörak), on vaja footonit energiaga
Üldiselt on vektor magnetresonantsi seadme tekitatud välise välja ja prootonit ümbritsevate aatomite ja nende tuumade tekitatud sisevälja vektorsumma. Spinni pöörakuid registreerides saadakse tuumamagnetresonantsi (TMR) spektrid, millede järgi saab aineid identifitseerida.
Pauli keeluprintsiip
Aatomites või muudes lõksudes olevad elektronid järgivad Pauli keeluprintsiipi ehk välistusprintsiipi: ühte ja samasse püünisesse sulustatud kahel elektronil ei saa olla ühesugust kvantarvude komplekti.
Perioodilisussüsteemi koostamine
Perioodilisustabelis on elemendid järjestatud aatomnumbri kasvu järjekorras. Aatomi tuumalaeng on . Prootonite arv tuumas ja elektronide arv neutraalses aatomis on .
Seisundid kvantarvu ühesuguse väärtusega moodustavad elektronkihi, ühesuguse ja väärtusega seisundid aga alamkihi. Täidetud kihtidel ja alamkihtidel, mis sisaldavad maksimaalset võimalikku arvu elektrone, puudub impulsimoment ja magnetmomendid (s.t need on võrdsed nulliga).
Röntgenkiired ja elementide järjestamine
Röntgenkiirte lausspekter (pidev spekter) tekib, kui suure energiaga elektronid kaotavad tuumadega põrkudes energiat. Piirlainepikkus kiiratakse, kui elektronid kaotavad kogu oma energia ainsas põrkes; see võrdub
kus on põrkuvate elektronide algne kineetiline energia. Karakteristliku röntgenspektri annavad suure energiaga elektronid, mis löövad elektrone aatomi sügavamaist elektronkihtidest välja. Kui sügavamasse kihti tekkinud augu täidab elektron mõnest välimisest kihist, kiiratakse karakteristliku kiirguse footon.
Briti füüsik H.G.J. Moseley mõõtis aastal 1913 ära terve rea elementide karakteristlikud röntgenkiirguse spektrid. Ta tuvastas, et kui kanda graafikule ruutjuur röntgenkiirguse footoni sagedusest sõltuvana elemendi aatomnumbrist , saadakse sirge joon (Moseley graafik, joonis 40-17). Siit järeldas Moseley, et elemendi asendit perioodilisustabelis ei määra mitte selle aatomi mass vaid aatomnumber .
Laserid ja nende kiirgus
Laserivalgus tekib stimuleeritud siiretel, see on stimuleeritud kiirgus, mis kiiratakse, kui footon sagedusega
sunnib aatomit siirduma kõrgemalt energiatasemelt madalamale tasemele . Siis kiiratakse sundivale footonile lisaks sellega identne footon sagedusega . Et stimuleeritud kiirgus saavutaks ülekaalu neeldumise üle, peab kahe energiataseme vahel laserkiirguri aatomites olema pöördhõive, s.t kõrgemal tasemel peab olema rohkem aatomeid kui madalamal.