Selles kursuses õpime lähemalt tundma nähtusi, mis on igapäevakogemusest juba tuttavad. Näiteks on kõik tundnud, et tassi sang läheb tasapisi kuumaks, kui tass täita kuuma teega (sellistest nähtustest räägib soojusõpetus). Tuttav on ka see, et elekter toob tuppa valguse ning paneb käima paljud kodumasinad (kõikvõimalikud elektrinähtused).
Juba 7. klassi loodusõpetuses olete õppinud, et kõik kehad koosnevad aatomitest ja molekulidest. 8. klassi keemias õppisite tundma keemilisi reaktsioone.
Selles füüsikakursuses saate teada, kuidas on kehade siseehitusega seotud nende soojuslikud ja elektrilised omadused. Kuid kõigepealt räägime veel kord aatomistest ja molekulidest, kuna füüsika ja füüsikud tunnevad mikromaailma kõige paremini.
Milline on kaasaegne ettekujutus aatomi ehitusest? Praeguseks on paljud eksperimendid tõestanud, et aatomituum koosneb positiivselt laetud prootonitest ja laenguta neutronitest, nende ühine nimetus on nukleonid. Prootonil ja neutronil on praktiliselt sama mass, mis vesiniku aatomituumal, ning prootonid ja neutronid moodustavad suurema osa aatomi massist.
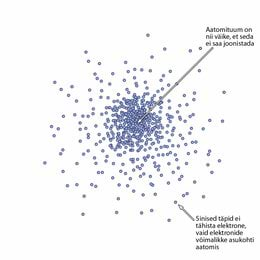
Loomulikult on aatomites ja molekulides ka elektronid. Aga seda „olemist“ ei tohiks ette kujutada kui elektronide liikumist mööda mistahes trajektoori, olgu see siis ringjoon või siksak – kaasaegne füüsika ütleb, et elektronil ei saa olla trajektoori. Pigem kujuta seda ette pilvena – elektronpilvena.
Elektronpilv on füüsikaline mudel, mis illustreerib seda, et ei ole võimalik teada täpselt, kus asub elektron, aga teada on, et ta asub kusagil selle pilve sees. Suurem tõenäosus on leida elektron sealt, kus on pilve tihedamad piirkonnad. Elektroni trajektoorist ei saa rääkida, sest kvantmehaanika seaduste järgi ei ole võimalik mõõta üheaegselt elektroni asukohta ja kiirust.
Elektronpilve kujutise tekkimist saab uurida arvutisimulatsioonis. Pilve kujutis tekib, kui mõõta palju kordi elektroni asukohta.
Ainult vesiniku aatomi elektronpilv saab olla kerakujuline. Suurema aatommassiga aatomite, samuti molekulide elektronpilved on suuremad ja teistsuguse kujuga. Siiski, aatomite ja molekulide füüsikaliselt korrektne kujutamine tähendab alati aatomituuma või tuumade asukoha tähistamist ja elektronpilve kujutamist.
Loodusainetes me räägime harva üksikutest aatomitest. Keemias ja bioloogias on olulised ikkagi mitmest aatomist koosnevad molekulid. Mis saab elektronidest molekulides?
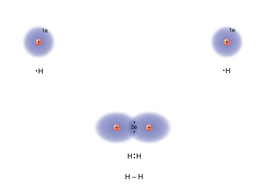
Keemias te olete juba õppinud liitaineid ehk keemilisi ühendeid. Te teate, et kovalentne side on ühiste elektronpaaride abil tekkinud side ja iooniline side on siis, kui vastasmärgilised ioonid tõmbuvad. Loomulikult saab keemiliste sidemete tekkimist ka füüsika keeles selgitada ja just füüsika on teadus, mis tungib sügavamale aine ehituse seaduspärasustesse, andes muuhulgas ka keemiale selle tööriistad. Selles kursuses me puudutame mikromaailma füüsikat vaid riivamisi, jättes seega kõrvale ka kvantarvutid, teleportatsiooni, Universumi tekkimise jms küsimused. Ütleme lihtsalt, et kovalentse sideme moodustab (väliskihi) elektronide elektronpilv, mis haarab mõlemaid sidemes osalevaid aatomeid. Ja rõhutame, et tegelikult ei saa rääkida elektronide liikumisest ümber mõlema aatomi sest elektronidel ei ole trajektoori, neid võib lihtsalt ühest või teisest kohast suurema tõenäosusega leida. Mikromaailma seadused võivad esmatutvusel veidrad tunduda.
Kuidas siis ikkagi joonistada molekuli?
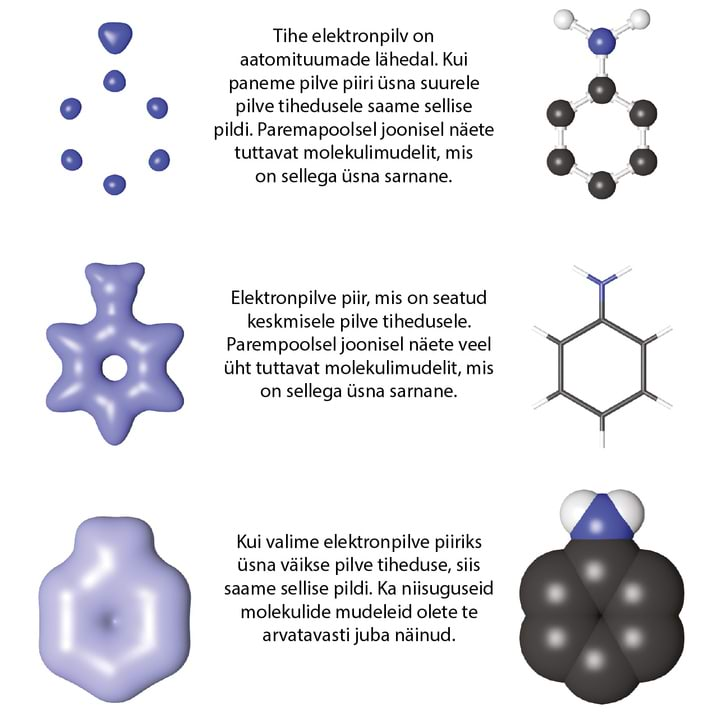
Igasugust pilve, nii ka elektronpilve on keeruline joonistada – kuhu joonistada pilve piir? Sest pilv on erinevates kohtades erineva tihedusega, tihti keskel tihedam, servadelt hõredam. Lahendus on välja valida mingi konkreetne pilve tiheduse väärtus ja joonistada pilve piir mööda seda. Nii tehakse ka elektronpilvedega.
Vaatame seda protsessi ühe keerukama molekuli elektronpilve näitel. Ja võrdleme saadud pilte teada-tuntud molekulide mudelitega.
Bioloogilised molekulid on tihti väga mahukad ja keerukad. Nende struktuuri joonistamisel jäetakse üksikud aatomid tähistamata, koos sellega jäetakse tähistamata ka elektronpilved.
Selles õpikus me keskendume aine füüsikalistele omadustele. Aga tuleks endale aru anda, et ehkki füüsika, keemia ja bioloogia räägivad vahel üsna erinevates keeltes, on nende uurimisobjekti, so loodust kirjeldavad seadused universaalsed, erinevad vaid vaatepunktid. Üritame seda järgnevas ka läbi näidete demonstreerida.
Peame siin ütlema ka mõne sõna ka valguse kohta. 8. klassis oli valgus meie jaoks valgusallika poolt kiiratav elektromagnetlaine, mille levimist saab kirjeldada kiirteoptika seaduspärasustega ja me ei uurinud, mis toimub näiteks siis, kui valgus neeldub ekraanis või valgusfiltris.
Kaasaegses ettekujutuses on valgus kvanditud, st valgus koosneb valguse osakestest. Valguse osakesi (kvante) kutsutakse footoniteks.
Valguse vastastikmõjus ainega antakse energiat ja impulssi üle footonite kaupa.
Igale footonile vastab ka kindel energia. Sagedusega ja lainepikkusega elektromagnetlaine footoni energia on määratud valemitega
Footoni energiast (seega ka valguse lainepikkusest) sõltub, milliseid protsesse selline footon saab esile kutsuda.
Footonite energiad mõõdetakse tavaliselt elektronvoltides (). on väga väike energia, võrdudes džauliga.
Valguse lainepikkus ja sagedus on omavahel seotud avaldisega
Kaasaegne ettekujutus aatomist
Aatomituum koosneb positiivselt laetud prootonites ja laenguta neutronitest, nende ühine nimetus on nukleonid. Aatomituuma ümber on elektron, mida kujutatakse elektronpilvena.
Soojusõpetuses nimetatakse kehadeks kõiki meid ümbritsevaid objekte ehk asju.
Me juba teame, et kõik kehad koosnevad kas ühest ainest või on nad ainete segud. Ained omakorda koosnevad aineosakestest. Aineosakesteks võivad olla nii molekulid, ioonid kui ka aatomid, sõltuvalt sellest, millise ainega on tegemist. Molekulidest koosneb näiteks vesi. Ka õhk koosneb molekulidest, aga see on mitme aine segu. Keedusool ning söögisooda aga koosnevad ioonidest. Tuntumateks aatomitest koosnevateks aineteks on grafiit ja teemant.
Ained võivad esineda kolmes olekus: tahke, vedel ja gaasiline.
Järgnevalt uurime lähemalt, kuidas aineosakesed erinevates aine olekutes paiknevad ning teineteist mõjutavad.
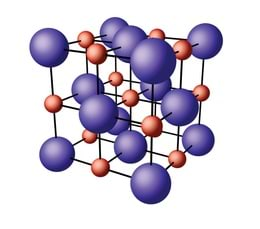
Tahkes aines paiknevad aineosakesed üksteisele väga lähedal. Kristallilistes ainetes paiknevad aineosakesed ka korrapäraselt. Näiteks soolakristallis on iga naatriumi ioon (Na+) ümbritsetud kuue kloori iooniga (Cl-) ning iga kloori ioon on ümbritsetud kuue naatriumi iooniga. Samal ajal klaasides ja polümeerides, mis on ju ka tahked ained, ei paikne aatomid korrapäraselt.
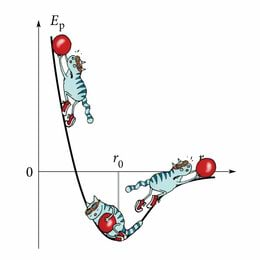
Kõik aineosakesed mõjutavad üksteist – aineosakeste vahel esinevad tõmbe- ja tõukejõud. Selliseid jõude aitab mõista see, kui kujutame ette, et aineosakeste vahele on kinnitatud vedrud. Kui lükkame kuule üksteisele lähemale, tekib vedrus tõukejõud, mis lükkab kuulid üksteisest eemale. Kui venitame kuule üksteisest eemale, tekib vedrus tõmbejõud, mis tõmbab kuulid üksteisele lähemale. Aineosakeste vastastikmõju annab aineosakestele potentsiaalse energia üsna samamoodi, nagu kõikidel kehadel on Maa gravitatsioonijõu tõttu potentsiaalne energia.
Milline salapärane jõud aineosakeste vahel mõjub? Soolakristallis ju pisikesi vedrusid ei ole?
Naatriumi ja kloori ioonide vahel mõjuv tõmbejõud on elektrijõud, millest räägime täpsemalt selle õpiku teises osas ja mida keemias nimetame iooniliseks sidemeks.
Tõukejõu põhjustab keeluprintsiip – kaks aineosakest ei saa korraga ühes ja samas kohas olla. Nii tekib aatomite vahel tõukejõud kohe, kui aatomi kooseisus olevate elektronide elektronpilved kokku puutuvad.
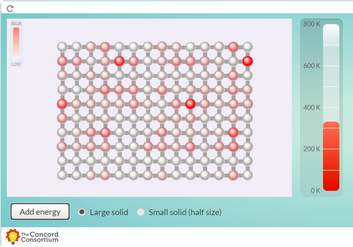
Tahkes aines võnguvad aineosakesed tõmbe- ja tõukejõudude tasakaalupunkti ümber. Aineosakeste liikumine tähendab, et neil on lisaks tõukumise–tõmbumise potentsiaalsele energiale olemas ka kineetiline energia. Sellist võnkumist saab uurida arvutisimulatsioonide abil.
Tahkistes on aineosakeste kineetiline energia palju väiksem osakeste vahel mõjuvate tõmbejõudude potentsiaalsest energiast – kui see oleks vastupidi, siis lendaks tahkis laiali.
Tänapäeval suudavad teadlased üksikute aatomite ja molekulide asukohti määrata.
Vedelikud tunneme ära selle järgi, et nad voolavad. Me ei saa valmistada vedelikest esemeid, kuna nad ei säilita oma kuju. Kallates vedeliku anumasse, võtab vedelik anuma kuju, sest gravitatsioonijõud tõmbab vedelikku maapinna poole.
Kui vedelik seisab liikumatult anumas, siis selle aineosakesed enamasti võnguvad ühe koha peal – samamoodi on see ka tahkes aines. Aga erinevalt tahkest ainest on vedelikes aineosakesed võimelised ka liikuma – aeg-ajalt nad pääsevad naaberosakeste vahelt läbi.
Vedelikes on aineosakeste kineetiline energia ligikaudu sama suur, nagu on osakeste vahel mõjuvate tõmbejõudude potentsiaalne energia.
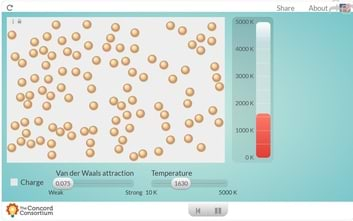
Aineosakeste liikumist vedelikes saab uurida arvutisimulatsioonide abil.
Vedelike aineosakeste liikumise simulatsioonist (küllap ka igapäevakogemustest) peaks selge olema, et ilma segamata võtab kahe vedeliku segunemine omajagu aega. Siiski segunevad vedelikud ka siis, kui nad on paigal. Näiteks kui paneme vee sisse mõne tera kaaliumpermanganaati (vees lahustuv lilla aine) ja jätame selle mõneks tunniks seisma, siis muutub vesi ühtlaselt lillaks ka siis, kui me seda ei sega. Sellist ainete iseeneslikku segunemist nimetatakse difusiooniks. Vedelikes esinev difusioon on väga oluline taimedele, kuna just difusiooni kaudu saavad taimed omale vajalikke toitaineid.
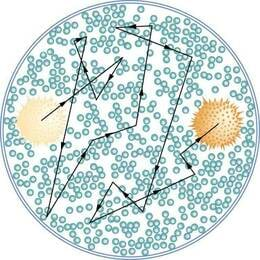
Gaasid erinevad vedelikest ja tahkistest selle poolest, et gaasides on aineosakesed üksteisest väga kaugel – keskmine vahemaa kahe aineosakese vahel gaasis on sadu kordi suurem nende osakeste raadiusest. Seetõttu on ka osakestevahelised jõud väikesed ja nende liikumine vabam.
Gaasides liiguvad aineosakesed sirgjooneliselt ning korrapäratult. Aineosakesed muudavad oma suunda ainult siis, kui nad teise osakesega kokku põrkavad.
Gaasides on aineosakeste kineetiline energia palju suurem osakeste vahel mõjuvate tõmbejõudude potentsiaalsest energiast.
Üllataval kombel on gaaside ja vedelike mehaanilised omadused sarnased. Seetõttu on neil olemas ka ühine nimi – voolised (ingl fluids). Näiteks difusioon ei esine ainult vedelikes, vaid isegi tugevamalt gaasides. Kui avada klassiruumi ühes otsas tugeva lõhnaga aine pudel, siis on mõne aja pärast tunda seda lõhna ka klassi teises otsas. Kui siin alapeatükis esitatud simulatsioone võrrelda, peaks selle põhjus selge olema: kuna gaasides on aineosakeste vaba tee pikkus oluliselt suurem, siis jõuavad nad ka kaugemale.
Katseliselt saab demonstreerida, et õhust raskemad (st õhust keskmiselt suurema molaarmassiga) gaasid täidavad anumaid samamoodi nagu vedelikud. Raske gaasina võime kasutada näiteks süsinikdioksiidi või eriti rasket gaasi, mille nimi on väävelheksafloriid.
Difusioon vähendab tasapisi raskete gaaside hulka lahtistes anumates.
Kõik ained ei ole ainult kas tahked, vedelad või gaasilised.
Näiteks mõned ained küll voolavad, aga väga aeglaselt. Neid nimetatakse amorfseteks aineteks või tahketeks vedelikeks. Amorfsete ainete voolamise kiirus sõltub temperatuurist, madalal temperatuuril on nende voolavus väga väike. Amorfne aine on näiteks pigi – kui justkui tahke pigi tükk jätta pikaks ajaks lauale, siis see vajub seal laiali nagu vedelik.
On olemas veelgi veidramaid aineid, näiteks mänguasjade kauplustes müügil olev nn tark plastiliin. Tark plastiliin käitub aeglasel deformatsioonil viskoosse vedelikuna, kiirel deformatsioonil elastse tahke kehana. Sellepärast on targast plastiliinist palli võimalik nii põrgatada kui ka plastiliinina vormida.
Aineosakeste vastastikmõjuenergia
Aineosakeste vahel esinevad tõmbejõud annavad aineosakesele vastastikmõju potentsiaalse energia.
Solid substance or solid
In solids (solid bodies), the particles of matter are close together. In the solid state, the kinetic energy of the particles of matter is much smaller than the potential energy of the attractive forces acting between the particles. The peculiarity of solids is revealed by deformation: only solids resist deformation. The common property of liquids and solids is the conservation of volume, which is why they are called condensates.
Liquid
In liquids, the particles are close together but can still move. Liquids always take the shape of a container. In the liquid state, the kinetic energy of the particles of matter is approximately the same as the potential energy of the attractive forces acting between the particles.
Kallame ühte klaasi 80-kraadist vett ning teise 20-kraadist vett. Lisame mõlemasse klaasi paar kristalli kaaliumpermanganaati vaatleme nõusid mõne minuti jooksul.
Märkame, et soojemas vees on aine rohkem lahustunud ning suurem osa veest on värvunud lillakaks. Külmemas anumas on tekkinud lillakas lahus ainult klaasi alumisse ossa, kristallide ümber.
Vaatame nüüd uuesti juba tuttavat simulatsiooni gaaside segunemisest ja muudame sel korral ka temperatuuri. Kuidas sõltub difusiooni kiirus temperatuurist?
Simulatsioonis näeme, et kõrgema temperatuuri juures liiguvad aineosakesed kiiremini. Seetõttu nimetatakse aineosakeste korrapäratut liikumist ka soojusliikumiseks. Kaudselt kinnitab seda seaduspärasust ka katse kaaliumpermanganaadiga – nii simulatsioon kui ka katse näitavad, et kõrgema temperatuuri juures toimub difusioon kiiremini.
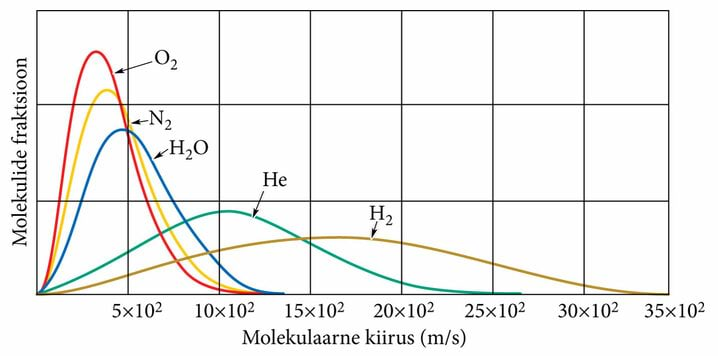
Uurides simulatsiooni, on ka lihtne näha, et aineosakesed liiguvad soojusliikumises erineva kiirusega ja nende kiirus muutub põrgetes. Ühel ajahetkel võivad olla ühed osakesed peaaegu paigal (siis kui põrkavad kokku mõne teise aineosakesega), teised liiguvad aeglasemalt, kolmandad päris kiiresti. Gaasides muutuvad toatemperatuuril osakeste liikumiskiirused väga suurtes piirides, eri osakeste kiirus võib olla 100–1000 m/s, kuid enamiku osakeste liikumiskiirus jääb kuskil 400–500 m/s juurde.
Mehaanikast teame, et mida suurem on keha kiirus, seda suurem on selle liikumise energia ehk kineetiline energia. Äsja saime teada, et mida suurem on osakeste liikumiskiirus, seda kõrgem on selle keha temperatuur. Seega võime öelda, et mida kõrgem on keha temperatuur, seda suurem on aineosakeste kineetiline energia.
Aineosakeste kineetilise ja potentsiaalse energia summat nimetatakse keha siseenergiaks. Kui aine olek ei muutu, suureneb keha siseenergia temperatuuri tõustes, st muutub aineosakeste kineetiline energia. Kui aine olek muutub, siis muutub nii aineosakeste potentsiaalne kui ka kineetiline energia.
Osakeste soojusliikumise muutumist temperatuuri kasvades saab uurida arvutisimulatsioonides.
| Kuidas muutub tahke aine aineosakeste soojusliikumine, kui ainele temperatuuri tõsta? | Selles arvutisimulatsioonis saad muuta aine temperatuuri ning aineosakeste omavahelise tõmbejõu suurust ja iseloomu. Muutke neid parameetreid ja uurige, mis juhtub. Pane tähele, et simulatsioonis puudub gravitatsioon, mistõttu moodustab vedel aine tilga, mitte ei vaju alla. |
Aineosakesed ja temperatuur
Mida soojem on keha, seda suurem on aineosakeste soojusliikumise keskmine kiirus.
Kui puhume õhupalli soojas toas täis ja läheme sellega talvel õue, märkame, et õhupall muutub väiksemaks. Tagasi tuppa minnes paisub õhupall jälle suureks. Miks?
Me juba teame, et kui temperatuur tõuseb, kiireneb aatomite ja molekulide soojusliikumise kiirus. Mida suurem kiirus, seda tugevama „müksu“ annab aatom või molekul, kui ta vastu gaasi ümbritsevat kesta põrkab. Nii juhtubki, et õhupalli saab suuremaks „puhuda“ nii sinna õhku juurde puhudes (st aineosakesi lisades) kui ka temperatuuri tõstes.
Nähtust, kus kehade suurus muutub temperatuuri muutumisel, nimetatakse füüsikas soojuspaisumiseks. Gaaside soojuspaisumine toimub alati kindla seaduspära järgi – gaasi ruumala muut on võrdeline temperatuuri muuduga.
Ka soojuspaisumise põhjuseid saab uurida arvutisimulatsioonides.
Kas ka vedelikes toimub soojuspaisumine? Selle uurimiseks tuleks täita pudel ääreni kuuma veega ning jälgida, kuidas veetase muutub, kui vesi jahtub. Selgub, et kui vesi jahtub, siis vedeliku tase alaneb.
Enamiku vedelike soojuspaisumise ja jahtumise korral kehtib seaduspärasus, et vedeliku ruumala muut on võrdeline temperatuuriga muuduga.
Tahkete kehade puhul kehtib sama seaduspärasus, mis vedelike ja gaaside korral: keha ruumala muut on võrdeline temperatuuri muuduga. Tahketel kehadel on mõõtmed, seega saame sõnastada soojuspaisumise seaduspärasuse järgmiselt: keha pikenemine on võrdeline temperatuuri muuduga.
Tahkete kehade paisumist ei pruugi alati näha olla, kuid sellega tuleb arvestada. Näiteks kui valada külma klaasi kuuma vett, võib klaas puruneda – kohas, kus klaas puutub kokku kuuma veega, hakkab klaas paisuma ning tekivad sisepinged. Tahke keha soojuspaisumisega tuleb arvestada ka sildade ja raudteede ehitamisel.
| Sellised ühendused lasevad raudteel soojuspaisumises pikeneda. Tänapäeval on raudteerööpad siiski üksteise külge keevitatud. Kui rööpad on tugevalt liiprite külge kinnitatud, siis soojuspaisumisel surutakse need kokku ja jahtumisel neid venitatakse. | Paisumispraod betoonplaatide vahel, mis lubavad plaatidel paisuda ja kokku tõmbuda. |
Mehaanikas õppisime, et kui keha tihedus on väiksem kui seda ümbritseval keskkonnal, mõjub talle üleslükkejõud. Sarnaselt tõuseb külmema õhu keskel ülespoole soe õhk ning jahedama vee hulgas soe vesi, sest, vedelikud ja gaasid soojenedes paisuvad.
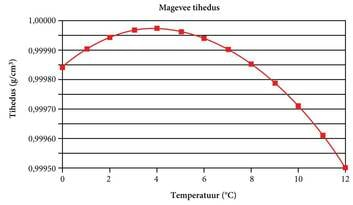
On olemas ka üks erijuht, millel on looduses erakordselt suur tähtsus. Nimelt ei ole veekogudes talvel kõige külmem vesi mitte veekogu põhjas, vaid hoopis pinna lähedal. Seetõttu ei külmu veekogud talvel põhjani kinni ja jätavad kaladele võimaluse külm aeg üle elada. Miks see nii on?
Selgub, et vee tihedus on kõige suurem mitte vahetult enne külmumist 0 kraadi juures, vaid 4 kraadi juures. Nii kogunebki talvel põhja lähedale 4-kraadine vesi, veepinnale aga 0-kraadine vesi, mis külmub.
| Vesi on üks väheseid erandeid, mille puhul ei kehti vedelike soojuspaisumine. Kui me hakkame alandama toasooja vee temperatuuri, siis vee ruumala väheneb kuni 4 °C-ni. Sealt edasi jahutades hakkab vee ruumala uuesti suurenema. | Veekogu põhjas on vee temperatuur 4 °C, seetõttu jäätub vesi ainult pinnalt ja veekogud ei külmu põhjani kinni. Seda põhjustab vee eriline soojuspaisumine. |
Temperatuuri mõõtmiseks saab kasutada gaaside ja vedelike soojuspaisumist.
Vedeliktermomeetri alumises osas on väike anum, mis on täidetud vedelikuga ja ühendatud peenikese suletud toruga. Kui vedeliku temperatuur tõuseb, siis vedelik paisub ning veetase torus tõuseb. Kui temperatuur langeb, siis vedeliku ruumala väheneb ja veetase torus langeb. Toru kõrval olevalt skaalalt saame lugeda temperatuuri. Välitermomeetrites kasutatakse vedelikuna enamasti värvitud piiritust. Vett pole seal võimalik kasutada, sest vesi jäätub juures – selle peale termomeeter puruneks. Meditsiinilistes termomeetrites kasutatakse vedelikuna galliumi.
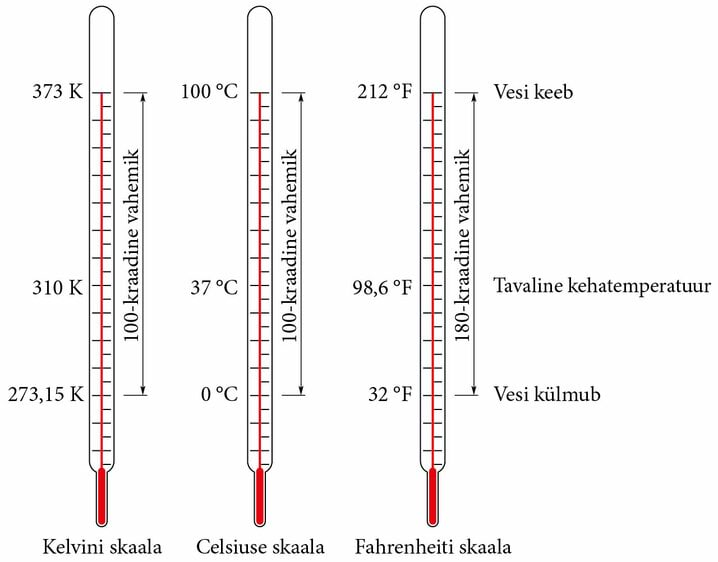
Selles õpikus kasutame temperatuuri ühikuna Celsiuse kraadi (). Celsiuse temperatuuri skaala on paika pandud vee sulamis- ja keemistemperatuuri järgi. -ks on võetud see temperatuur, mille juures puhas vesi jäätub. -ks on võetud temperatuur, mille juures puhas vesi normaalrõhul keeb. Vahemik vee sulamis- ja keemistemperatuuride vahel on jaotatud sajaks osaks.
Celsiuse skaalat kasutatakse igapäevaelus laialdaselt. Füüsikas kasutatakse enamasti Kelvini temperatuuriskaalat (ühiku tähis ), mida nimetatakse ka absoluutseks temperatuuriskaalaks. Kelvini skaalas on ühe kraadi vahemik sama, mis Celsiuse skaalal, erinevus seisneb ainult nullpunktis.
Kelvini skaala () on kõige madalam temperatuur, mida on võimalik saavutada. See on kõige madalam temperatuur seetõttu, et aine temperatuur on seotud aineosakeste liikumiskiirusega ning juures on aineosakesed paigal ning nende liikumist ei ole enam võimalik rohkem aeglustada.
Paljudes riikides kasutatakse tänapäeval Celsiuse temperatuuriskaalat, kuid näiteks USA-s on levinud Fahrenheiti skaala. Fahrenheiti skaala ja Celsiuse skaala erinevusi saad võrrelda alljärgneval joonisel.