Kui paneme vee sügavkülma, see mõne aja pärast jäätub. Kui võtame tekkinud jää sealt välja ja hoiame seda käes, siis tunneme, et käsi muutub külmaks ning tahke jää muutub osaliselt veeks.
Need protsessid on meile hästi tuttavad. Protsessi, kus tahke aine muutub vedelaks, nimetatakse sulamiseks. Vedela aine muutumist tahkeks aineks nimetatakse tahkumiseks.
Kuidas liigub energia nendes protsessides?
Meie käsi tunneb külma, kui see jahtub, ning jahtub siis, kui annab osa oma aineosakeste soojusliikumise energiast, s.o siseenergiast ära. Jää sulamisel tunneme külma. Sellest saame järeldada, et jää sulamiseks on vaja energiat, mis alati võetakse soojusvahetuse kaudu ümbritsevatelt kehadelt.
Kuidas vee tahkumist uurida? Selleks saab hästi kasutada jäävett, mida suvel palava ilmaga on mõnus juua. Kas oled kunagi mõõtnud jäävee temperatuuri?
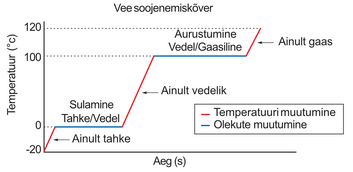
Valame klaasi toasooja vett, lisame sinna sisse jääkuubikuid ja mõõdame siis vee temperatuuri. Temperatuur hakkab langema ning mõne aja pärast on see 0 ºC ning enam allapoole ei lange. Järelikult on meil saavutatud soojuslik tasakaal jäätükkide ja vee vahel – mõlema temperatuur on 0 ºC.
Mis juhtub kui lisada 0 ºC jäävette –20 ºC jääkuubik? Kas jäävee temperatuur langeb nüüd alla 0 ºC? Katseliselt veendume, et ükskõik, kui palju ja kui külma jääd me vette ei paneks, jäävee temperatuur on ikka 0 ºC. Samas aga hakkab lisatud jää temperatuur tõusma. Teame, et keha temperatuuri tõstmiseks on vaja energiat. Kust see energia võetakse?
Märkame, et kui lisame 0 ºC jäävette –20 ºC jääd, siis osa vett jäätub. Vesi jäätub seetõttu, et jää temperatuur hakkab tõusma ning temperatuuri tõusmiseks vajalik soojushulk saadakse vee jäätumisel ehk tahkumisel.
Aine sulamiseks on vaja energiat. Tahkumise käigus energiat alati eraldub.
Katsest saame järeldada veel seda, et sulamine/tahkumine toimub ühel kindlal temperatuuril, mida nimetatakse aine sulamistemperatuuriks. Sulamise ja tahkumise käigus aine temperatuur ei muutu, seetõttu on ka jäävee temperatuur alati 0 ºC.
Kuna jäävee temperatuur sulamise/jäätumise käigus ei muutu, siis järelikult ei muutu ka osakeste liikumiskiirus (kineetiline energia). Samas aine siseenergia peab sulades muutuma, kuna sulatamiseks antakse ainele energiat juurde. Seega muutub sulamise ja tahkumise käigus osakeste potentsiaalne energia: kui temperatuur tõuseb, siis osakesed nihkuvad üksteisest kaugemale ja suureneb vastastikmõju potentsiaalne energia.
Mõnedele ainetele on sulamiseks vaja rohkem energiat, teistele vähem. Seda, kui palju energiat on vaja aine sulamiseks, iseloomustab aine sulamissoojus.
Sulamissoojus näitab, kui palju energiat on vaja anda 1 kg sulamistemperatuuril olevale ainele, et see täielikult sulatada.
Sulamissoojust tähistatakse kreeka tähega (loe: lambda) ning ühikuks on . Jää sulamissoojus on , mis tähendab seda, et 1 kilogrammi jää sulamiseks kulub 330 000 J energiat. Kuna sulamine ja tahkumine on pöördprotsessid, siis 1 kilogrammi vee jäätumisel eraldub 330 000 J.
Aine sulamiseks vajaminevat soojushulka saab järelikult arvutada valemiga
kus tähistab sulamissoojust ja aine massi. Levinumate ainete sulamissoojused leiad Lisast 9.1.2 või näiteks Vikipeediast.
Enamikul ainetel on tahke olek tihedam kui vedel olek. Taas on üks erandlikke aineid vesi: jää tihedus on väiksem kui vee oma. Sel põhjusel tõuseb jää vees pinnale ja järved saavad endale talvel jääkaane. Kuid samas kahjustab vee selline omadus paljusid ehitisi. Näiteks lõhub jää asfaltteid: vesi tungib asfalttee kivide vahele, külmaga jäätub ning paisub ja teele tekivad praod.
Näidisülesanne
Mitu grammi 0-kraadist jääd tuleb lisada 200 grammi 20-kraadisesse vette, et vesi 0-kraadini jahutada?
Lahendus
Andmed
TeX parse error: Extra close brace or missing open brace
Arvutused
Leiame soojushulga, mis eraldub vee jahtumisel -ni. Temperatuurimuutus .
Vesi annab jahtumisel oma soojushulga jää sulamiseks . Teades jää sulamiseks minevat soojushulka, saame leida vajamineva jää massi . Et
siis
Vastus. Selleks, et jahutada 200 grammi vett -ni, on vaja vette lisada 50 grammi jääd.
Energy of melting and solidification
Melting a substance requires energy. Solidification releases energy.
Meid ümbritseb igal pool õhk, mis koosneb gaasidest, peamiselt lämmastikust ja hapnikust. Keetes vett, muutub ka vesi gaasiliseks – vesi aurustub.
Protsessi, kus vedel aine muutub gaasiliseks, nimetatakse aurumiseks. Protsessi, kus gaasiline aine muutub vedelaks, nimetatakse kondenseerumiseks.
Kas vesi aurustub ainult keemise ajal? Kui peseme tahvli märja lapiga puhtaks, siis on tahvel märg, kuid varsti kuivab ära. Sarnaselt kuivab ära pesu nööril või veeplekk põrandal. Võime öelda, et vedelikud aurustuvad kõikide temperatuuride juures.
Kallame ühe klaasi poolenisti täis 20 ºC vett ning teise klaasi 80 ºC vett. Kuuma veega täidetud klaasi sisepind muutub niiskeks, kuid toatemperatuuril oleva vee klaasiga seda ei juhtu. Kuuma veega klaas muutub niiskeks, sest kuum vesi aurustub kiiresti ning aurustunud vesi kondenseerub klaasi jahedale pinnale. 20 ºC klaasi pinnale nähtavat niiskust ei teki, kuna madalama temperatuuri juures toimub aurustumine aeglaselt. Seega sõltub aurustumise kiirus vedeliku temperatuurist – mida kõrgem temperatuur, seda kiirem aurustumine.
Mõtleme nüüd aurustumisest aineosakeste soojusliikumise keeles. Me teame, et vedelikus on aineosakeste liikumiskiirused erinevad. Vedelik aurustub siis, kui mõnede aineosakeste liikumiskiirus on nii suur, et nad suudavad ületada osakestevahelised vastastikmõjud ja vedelikust välja liikuda. Katseliselt on teada, et selleks peab vee molekuli liikumiskiirus olema suurem kui 2200 m/s. Ilmselt on kõrgema temperatuuri juures selliseid aineosakesi rohkem ja aurustumine järelikult kiirem.
Aurustumise käigus vedelik ise jahtub, kuna suurema kiirusega aineosakesed tungivad vedelikust välja ning vedelikku jäävad aeglasemalt liikuvad osakesed. Osakeste liikumiskiirus aga määrab aine temperatuuri. Selleks et aurustumine saaks samal temperatuuril toimuda, tuleb ainele pidevalt energiat juurde anda. Energiat, mida on vaja, et 1 kg ainet aurustuks, nimetatakse aurustumissoojuseks.
Aurustumissoojus sõltub aurustatava vedeliku algtemperatuurist – jääkülma vee aurustumiseks tuleb see kõigepealt keemistemperatuurini soojendada ja ka selleks kulub energiat. Sellepärast kasutatakse ainete iseloomustamiseks veel üht füüsikalist suurust, mille nimi on keemissoojus (tähistatakse tähega ). Keemissoojus näitab, kui palju energiat on vaja anda 1 kg keemistemperatuuril olevale ainele, et see täielikult aurustada.
Keemissoojuse ühikuks on . Vee keemissoojus on , mis tähendab seda, et 1 kilogrammi 100 ºC vee aurustumiseks kulub 2,3 MJ energiat.
Aurustumiseks vajaminevat soojushulka saab leida valemiga
Erinevate ainete keemistemperatuure ja aurustumissoojuseid saab vaadata õpiku lisades olevast tabelist või usaldusväärsetest allikatest internetis, näiteks Vikipeediast.
Kasutame neid teadmisi reaaleluliste ülesannete lahendamiseks.
Näidisülesanne
Kui palju on energiat vaja, et aurustada 200 grammi 20 ºC vett?
Lahendus
Andmed
Arvutused
Enne kui saame leida aurustumiseks vajamineva soojushulga, peame leidma energia, mis on vajalik vee temperatuuri tõstmiseks -kraadini. Vastav temperatuurimuutus on .
Nüüd leiame soojushulga, mis kulub 100-kraadise vee aurustumiseks.
Kogu energia, mis kulub 200 grammi vee aurustamiseks, on seega nende summa:
Vastus. 200 grammi 20-kraadise vee aurustamiseks kulub 530 kJ.
Vedelike aurustumine
Vedelikud aurustuvad kõikide temperatuuride juures. Aurustumise kiirus sõltub vedeliku temperatuurist.
Keemissoojus
Keemissoojus näitab, kui palju energiat on vaja anda 1 kg keemistemperatuuril olevale ainele, et see täielikult aurustada.
Heat of vaporization
The amount of energy required to vaporize of substance is called the heat of vaporization. Since the heat of vaporization depends on the temperature, the tables show the boiling heat of the substance, i.e., the heat of vaporization at the boiling temperature.
The amount of heat required for evaporation can be found using the formula
where is the heat of boiling and is the mass of the substance to be heated.
Küttepuid ostes on võimalik valida väga erinevate puude vahel. Müüakse kaske, leppa, mändi, kuuske jm. Kas on vahet, millist küttepuitu osta?
Internetist leiad kindlasti, et erinevatel küttepuudel on erinev kütteväärtus. Kütteväärtus näitab, kui palju energiat eraldub 1 kg kütuse põletamisel. Aga lisaks puidu kütteväärtusele tuleb küttepuude ostmisel jälgida, kas tegemist on kuivade või märgade puudega. Märgade puude kütteväärtus on väiksem, kuna osa puidu põlemisel eraldunud energiast kulub küttepuudes oleva vee aurustamiseks.
Erinevate puude kütteväärtuseid saad vaadata Lisast 9.1.4.
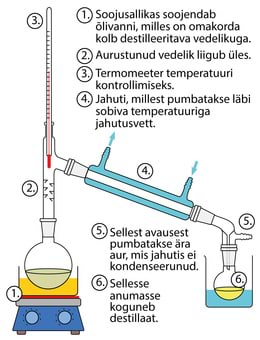
Destilleerimine on protsess, kus vedelik aurustatakse ning seejärel uuesti kondenseeritakse. Kuna ainete keemistemperatuurid on erinevad, saab destilleerimisega eraldada üksteises lahustunud aineid.
Näiteks piirituse keemistemperatuur on 78 ºC, vee oma 100 ºC. Kui aurustame vee ja piirituse segu ja jahutame seda 85 ºC-ni, siis vesi kondenseerub, aga piiritus mitte. Joonisel kujutatud seadmega (destillaator) on võimalik vesi ja piiritus teineteisest eraldada.
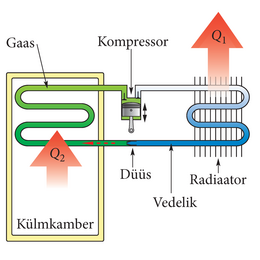
Külmkapi jahutussüsteemi kõige märgatavamaks osaks on kinnine toru. Selles torus liigub kergesti aurustuv vedelik, mida me siin nimetame jahutusseguks.
Külmkapi sees olevas toru osas on jahutussegu gaasilises olekus, auruna, kusjuures auru rõhk on madal ning auru temperatuur on veidi madalam külmkapi sees olevast temperatuurist.
Külmkapist toru kaudu väljuv jahutussegu aur satub kompressorisse, mis surub selle kõrge rõhu all olevaks ülekuumenenud auruks. Ülekuumenenud aur liigub jahtudes külmkapist väljas olevas toru osas ehk kondensaatoris ehk kondenseerijas (vanematel külmkappidel on seda võimalik näha külmkapi taha piiludes) ning kondenseerub. Selles protsessis eraldub ka soojus, mis antakse ära ümbritsevasse õhku.
Kondenseerijast väljudes on jahutussegu endiselt kõrge rõhu all, aga selle temperatuur on vaid veidi toatemperatuurist kõrgem. Nüüd surutakse jahutussegu läbi paisumisventiili, mis on tavaliselt lihtsalt väike ava. Ventiili taga olev keskkond on palju väiksema rõhu all ning seal toimub jahutussegu kiire paisumine ja aurustumine, aurustub umbes pool jahutussegust. Aurustumiseks vajalik soojus võetakse suuremalt jaolt sellelt jahutussegu osalt, mis jäi vedelasse olekusse.
Tekkinud külm ja osaliselt aurustunud jahutussegu liigub mööda torusid külmikus ja jahutab külmikut. Külmiku soe õhk soojendab torusid, mille tulemusena jahutussegu aurustub täielikult ja külmik jahtub veelgi. Täielikult aurustunud jahutussegu satub siis kompressorisse ja kogu tsükkel algab uuesti.
Tuntud katse teadusteatritest. Võtame suurema suuga pudeli, viskame sellesse (ettevaatlikult) põleva paberi ning asetame siis pudeli suule veega täidetud õhupalli. Õhupall imetakse pudelisse. Miks?
Selge on see, et õhupall läheb pudelisse siis, kui õhupallile ülalt ja alt mõjuv rõhk on erinevad (neid asju õppisime mehaanika kursuses). Et õhurõhk katse käigus ei muutu, siis saab rõhu erinevuse põhjuseks olla vaid rõhu vähenemine pudelis.
Tihti seletatakse seda katset nii, et pudelis olev õhk paberi põlemisel tekkiva soojuseneriga toel soojeneb ja paisub, pärast paberi kustumist jälle jahtub ja tõmbub kokku. Kuna muna katab terve pudeli suu nii, et õhk pudelist välja pääseb, aga välisõhk pudelisse ei pääse, siis rõhk pudelis väheneb ja muna "imetakse" pudelisse. See on füüsikaline seletus.
Vahel ka räägitakse et küünal "kulutab põledes kogu hapniku ära" ja alarõhk tekib just sellest. Põlemine on keemiline protsess.
Milline seletus on õige?
Teeme kontrollkatse. Paneme põleva küünla veeanumasse püsti ning asetame kummuli selle peale pudeli. Põleva paberi rolli täidab nüüd küünal ja õhupalli rolli anumas olev vesi.
Kui õhupalli pudelisse minek oleks põhjustatud õhu soojenemisest ja jahtumisest, siis peaks vesi sellises katses pudelisse tõusma pärast küünla kustumist. Hapniku "ära põlemise" teooria ennustab, et vesi tõuseb pudelisse nii kaua, kui küünal põleb, pärast seda tõus lõpeb.
Katses näeme, et vedeliku tase tõuseb ka siis, kui küünal põleb ning taseme tõus jätkub pärast küünla kustumist. Sellist tulemust ei ennustanud kumbki teooria.
Võtame appi keemia. Põlemine on keemiline protsess ja keemia annab selle teooria arendamiseks tööriistad. Eeldame, et küünlas põleb parafiin. Siis saame kirjutada
C31 H64 + 47O2 → 31CO2 + 32H2O
Seega tekivad küünla põlemisel süsinikdioksiid ja veeaur. Aga kui suur on reaktsioonisaaduste ruumala? Keemiast teame, et ühe mooli ükskõik millise gaasi ruumala standardtingimustel on alati ühesugune. Parafiini põlemisel reageerib 47 mooli gaasi ja tekib 63 mooli gaasi, nii et gaasi ruumala reaktsioonis hoopis suureneb.
Paberiga on samamoodi. Siis põleb tselluloos:
C6H10O5 + 3O2 → 6CO2 + 5H20
või mittetäielikul põlemisel
2C6H10O5 + 5O2 → 5CO + CO2 + 5H20
Gaasilise aine moolide arv kasvab, järelikult põlemisel gaasi ruumala hoopis kasvab?
Kui teise katse videot tähelepanelikult uurida, siis võib märgata, et pudeli siseküljele tekivad veepiisad. Reaktsioonis eraldunud veeaur kondenseerub pudeli seinale, mistõttu põlemise käigus gaasi normaaltingimustele vastav ruumala väheneb ja veetase pudelis tõuseb.
Pärast küünla kustumist gaas jahtub ja see on põhjus, miks veetase pudelis tõuseb ka mõnda aega pärast küünla kustumist.
On ka teada, et süsinikdioksiid lahustub üsna hästi vees ja osa gaasi võib niimoodi kaotsi minna. Aga see on pigem väiksem efekt.
Seega on vee kondenseerumine ning gaasi kokkutõmbumine jahtumisel kaks peamist põhjust, miks õhupall pudelisse läheb. Lisaks füüsikale tuleb appi võtta ka keemia.
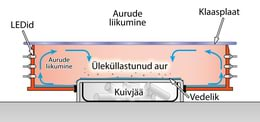
Kondenseerumisel töötab seade, mida nimetatakse udukambriks ja mille abil saab „näha“ kosmilist kiirgust. Seadme aluse keskosas asuvat metallplaati jahutatakse kuiva jääga (tahkes olekus süsinikdioksiid), mille temperatuur on alati –76 °C. Aluse servadel on soojem piirkond, kuhu valatakse isopropanool (külmumistemperatuur -89 ºC). Isopropanool aurustub ja levib kogu seadme kaanega suletud ruumis. Seadme külgedele on kinnitatud valgusallikad, mis võimaldavad seadmes toimuvat hästi näha.
Aluse külma osa kohal aur jahtub ja saavutab nn üleküllastunud oleku, kus ka kõige väiksem häiritus põhjustab selle kondenseerumise. Kui gaasiline isopropanool (aur) on läbipaistev, siis tilgakesteks kondenseerunud isopropanool on piimjas ja läbipaistmatu, moodustades aurus erineva kujuga udupilvi.
Kuna seade on sellistele häiritustele väga tundlik, siis saab udukambrit kasutada osakeste detekteerimiseks.
Et seade on üsna lihtsa ehitusega, saab seda ise teha ning kasutada näiteks kosmilise kiirguse uurimiseks. Kosmilisest kiirgusest räägime lähemalt õpiku viimases peatükis.