Atomismi idee pärineb antiikajast ja pikkadeks sajanditeks jäigi see ainult ideeks. Eksperimentaalsed meetodid arenesid alles 19. sajandil nii kaugele, et sai võimalikuks tõsiselt rääkida aatommassidest ja aatomite mõõtmetest. Samal ajal paranes jõudsalt arusaamine aatomitest, molekulidest ja keemilistest reaktsioonidest seoses keemiateaduse ning keemiatööstuse arenguga. 1870. aastaks sai esialgsel kujul valmis Mendelejevi tabel, aga selles kajastuvat elementide keemiliste omaduste perioodilisuse seadust polnud võimalik kuidagi põhjendada. Aatomite olemasolu ja ka see, et aatomid pole päris jagamatud, sai 20. sajandi algul üha rohkem kinnitust, aga esialgu oli lahtine, kus elektronid aatomis asuvad ja kuidas nad seal püsivad.
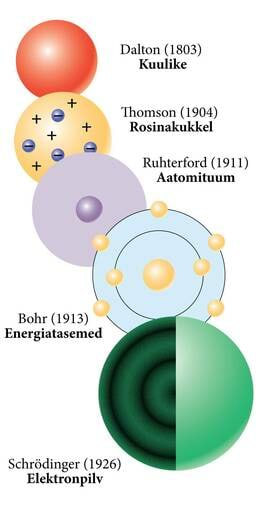
Aatomeid on sajandeid modelleeritud pisikeste kehakestena, mis koosnevad tundmatu päritolu, koostise ja ka tundmatute omadustega aatomiainest. Aatomi siseehitus ja kuju jäid saladuseks, sest inimese meeleorganid ei võimalda üksiku aatomi vaatlemist. Mingil moel lepime me praeguseni sellesama lihtsa ettekujutusega, kui kirjeldame näiteks soojusliikumist või difusiooni ja paneme värvilistest kuulikestest kokku molekulide mudeleid. Siiski, mudelikomplektis käib näiteks süsiniku kerakese külge alati neil sidet, aga vesinikule üks. See ei saa olla niisama, miski aatomi sees peab olema selle põhjuseks.
1897. aastal avastas J.J. Thomson katoodkiiri uurides esimese aatomist väiksema aineosakese, elektroni. Katoodkiired tekivad hõrendatud gaasiga täidetud klaastorus asuvate pingestatud elektroodide vahel, st tegemist on elektrivooluga hõredas gaasis või vaakumis. Tol ajal oli elektrivoolu olemus suureks mõistatuseks ja katoodkiired tähtis uurimisobjekt. Thomson näitas, et katoodkiired koosnevad negatiivse laenguga osakestest, mis on vesiniku aatomist üle 1000 korra kergemad. Kiiresti sai selgeks, et nii katoodkiirtes kui ka metalljuhtmetes kannavad elektrivoolu just elektronid. Avastus oli ka aatomiehituse alal läbimurdeks. Kuna elektronid võivad kanda aatomist välja negatiivset laengut, aga väga vähe massi, on loogiline arvata, et aatom koosneb põhiliselt positiivse laenguga raskest „aatomitaignast”. Nii pakkuski Thomson 1904. aastal välja esimese teaduslikult põhjendatud aatomimudeli, mida nimetatakse „ploomipudinguks”. Ploomipuding on traditsiooniline inglise jõulutoit, mis ei ole meie köögitraditsioonis eriti tuntud, seepärast on hakatud eesti keeles kasutama nime „rosinakukli mudel” (joonis 2.2.1.). Elektronid on selles mudelis nagu rosinad saias. Nimi ei ole väga õnnestunud, sest elektronid ei püsi paigal nagu rosinad, nad peavad aatomis tiirlema või võnkuma. Liikuvate elektronide kaudu saab põhjendada laengu ülekannet, elektrivoolu ja ka spektrite (erineva lainepikkusega valguse kiirgumise ja neeldumise) seletamiseks on lootust.
Rosinakukli mudel ei pidanud vastu kuigi kaua. Kohe pakuti välja ideid positiivse laengu asumisest aatomi keskel ja juba viie aasta pärast leiti aatomituum katseliselt. Sai selgeks, et ühtlast positiivse laengu pilve aatomis ei ole, rosinakukli mudelis on küll rosinad, aga saia ei ole. Aatomituumast ja sellega seonduvast tuleb juttu tuumafüüsika peatükkides. Aatomi elektronstruktuuri seisukohalt oli tuuma avastamine järjekordseks murdepunktiks. Aatomituum on aatomimõõtudes nii väike ja raske, et analoogia Päikesesüsteemiga on ilmne. Ka Päike on võrreldes planeetidega väga raske ja võrreldes kogu süsteemiga väga väike. Nii saigi uus mudel nimeks planetaarmudel. Analoogia oli tegelikult üsna kaudne. Polnud mingit põhjust arvata, et elektronid tiirlevad tuuma ümber ühes tasandis nagu planeedid ümber Päikese ja elektronid on kõik täpselt ühesugused, mida planeedid sugugi ei ole. Orbiitide idee sisaldus tegelikult juba Thomsoni mudelis, aga nende kuju ja stabiilset asetust isegi tuumaga aatomimudelis ei õnnestunud kuidagi klassikalise füüsika abil ennustada.
Aatomimudelid arenesid 20. sajandi algul väga kiiresti. Juba 1913. aastal avaldas Niels Bohr artiklite triloogia, kus aatomit on kirjeldatud kui positiivse laenguga tuuma ümber erineval kaugusel, kuid ainult kindlatel orbiitidel ringlevaid elektrone. Elektronid võivad ühelt orbiidilt teisele tõusta või langeda. Orbiidivahetusega kaasneb footoni kiirgumine või neeldumine. Lubatud orbiidil asuvad elektronid ei kiirga ega neela energiat, st energiatasemed aatomis on kvanditud. See viimane postulaat on vastuolus klassikalise elektrodünaamikaga. Kerkib küsimus, kuidas ja miks tiirlevad elektronid just lubatud orbiitidel ilma valgust kiirgamata?
Bohri aatomimudel võimaldas seletada vesiniku aatomi spektrijoonte koondumist seeriatesse ja andis päris hea alguse keemilise sideme ning elementide keemiliste omaduste põhjendamisele (joonis 2.2.3.). Kirjeldatud mudel on mingil moel segu klassikalisest ja kvantmehaanilisest käsitlusest ja selles ilmnesid, nagu kõigis eelmisteski, peagi puudused. Näiteks kirjeldub Bohri mudeliga ainult ühe elektroniga aatomi või iooni (eelkõige vesiniku) spekter, teiste aatomite spektrid paraku mitte.
Bohri aatom on esimene mikromaailma mudel, mis ei kasutata analoogiaid makromaailmast. Seepärast ei ole tal, erinevalt eelnevatest, kujundlikku nime. Mitte miski meie igapäevaste kehade maailmas ei käitu nii nagu elektronid aatomis. Elektron võib asuda näiteks teisel või kolmandal energiatasemel, aga ei saa asuda nende vahel. Me kõik võime elada teisel või kolmandal korrusel, aga kui me läheme teiselt kolmandale, oleme alati kasvõi korraks ka korruste vahel trepil. Intuitiivselt on vastuvõetamatu kujutleda, et mingi keha (näiteks elektron) saab kaduda ühelt orbiidilt ja ilmuda või tekkida teisel.
Praeguseks on teada, et elektronid ei liigu orbiitidel nagu kirjeldas Bohri-Rutherfordi aatomimudel. Ometi on see mudel paljudel juhtudel kasutamiskõlblik aatomitega toimuva kirjeldamiseks energiatasemete kaudu. Kui aatomi elektronkiht neelab kiirguskvante, lähevad elektronid suurema energiaga olekutesse. Bohri järgi läksid nad kõrgemetele (tuumast kaugematele) orbiitidele. Kasutades aatomi või molekuli elektronkatte lihtsustatud skeeme, nimetame suurema energiaga olekuid kõrgemateks energiatasemeteks. Joonistatakse neid tihtipeale siiski Bohri orbiitidena, eriti aatomite korral.
(Bohri aatomimudeli täpsema käsitluse leiad Henn Käämbre õpikust)
Bohri aatomimudel võimaldab küll elektronide orbiitide energiaid arvutada, aga ei näita põhjust, miks just need kindlad orbiidid (ehk energiatasemed) on lubatud. Siin tuleb appi dualismiprintsiip. 1924. aastal esitas Louis de Broglie käsitlusviisi, kus kõigi aineliste objektidega kaasneb laine. De Broglie lainepikkus () sõltub osakese impulsist, st massist ja kiirusest.
kus on Planki konstant, - impulss, - osakese mass ja - osakese kiirus. Valemist ilmneb, miks me makrokehade lainelisi omadusi ei märka. Kuna Plancki konstant on väga väike, on tavaliste kehade de Broglie lained käsitamatult lühikesed.
| Joonis 2.2.5. De Broglie laine mehaaniliseks analoogiks võiks olla kahest otsast kinnitatud keele võnkumine, aga veel parem on vaadata võnkuvat rõngast. Rõngal saab püsiv seisulaine tekkida siis, kui sinna sobitub täisarv lainepikkusi. Bohri mudeli orbiite peeti ringikujulisteks ja oli loogiline arvata, et lubatud orbiidid on need, kuhu mahub täisarv elektroni seisulaine lainepikkusi. Kuigi selle laine iseloomu kohta ei olnud veel midagi teada, sobis de Broglie elektronlaine mudelisse väga hästi. | Kass mängib keelpilli |
Niisiis, juba tuntud footonite lainelis-korpuskulaarne dualism (ptk Aatom) laieneb elektronile ja teistelegi osakestele. Seega ei kihuta Bohri aatomimudeli orbiitidel mitte pisikesed kerakujulised elektronid, vaid võnguvad elektronide seisulained. Lubatuks osutuvad need Bohri orbiidid, kuhu mahub täisarv lainepikkusi. Kuigi elektroni laineomadused sobisid aatomimudelisse hästi ja leidsid ka eksperimentaalset kinnitust (ptk Elektronide difraktsioon), peab ka siin esitama mõned küsimused:
- kas elektroniga kaasnevat lainet saab otseselt siduda mõne füüsikalise protsessiga ehk hästi lihtsalt küsides: mis lainetab?
- kuidas tõlgendada laine amplituudi?
Need küsimused viivad meid tagasi peatüki alguses lahtiseks jäänud küsimuse juurde, kus ja kuidas paiknevad elektronid aatomis? Klassikalises mehaanikas vastaks sellele küsimusele liikumisvõrrand. Meenutame näiteks teadusajaloos tuntud Kuu trajektoori probleemi lahendamist 17. sajandil. Newtoni seadused võimaldavad Kuu tiirlemist ümber Maa matemaatiliselt kirjeldada ja arvutada selle asukohta suvalisel ajahetkel. Kvantmehaanilises käsitluses on liikumisvõrrandi analoogiks Schrödingeri võrrand, mis kirjeldab aatomite, molekulide, aga ka aatomiosakeste kvantolekuid. Erinevalt klassikalisest mehaanikast ei ole võrrandi lahendiks elektroni trajektoor või asukoht mingil ajahetkel, vaid leiulaine (lainefunktsioon) (ptk Elektronide difraktsioon). Tuleb leppida, et elektroni asukoha, trajektoori või orbiidi asemel on tõenäosus leida elektroni aatomi, molekuli või kristalli mingis kohas. Leiulaine suurem amplituud vastab suuremale tõenäosusele.
Kvantmehaanika algust seostatakse enamasti Plancki 1900. aasta kvanthüpoteesiga (ptk Einsteini fotoefekti teooria), mis kvantiseeris ainult kiirguse. Teadusajalugu teeb vahet kaasaegsel kvantmehaanikal ja varastel kvantteooriatel. Viimaste hulka loetakse ka poolklassikalised teooriad nagu näiteks Bohri aatomimudel ja isegi de Broglie lained. Kvantmehaaniliste mudelite ja seega ka kaasaegses mõttes kvantmehaanilise maailmapildi alguseks loetakse 1926. aastat, mil Schrödinger avaldas oma võrrandi (ptk Kopenhaageni tõlgendus) De Broglie teoorias oli arvestatud, et osakesega ongi seotud mingisugune reaalne laine. Tegelikult on aineosakeste laineomadus esitatud Schrödingeri võrrandis leiulainena, mis on matemaatiline, tõenäosuslik tõlgendus. Ei saa öelda, et mingi füüsikaline objekt selles lainetab. Vaatamata sellele, et kvantmehaanilised mudeleid on intuitiivselt hoomamatud ja raskesti visualiseeritavad, on kvantmehaanika tänapäeva füüsika üks põhialustest ja paljud füüsika-, keemia- ja bioloogiaharud oleksid ilma kvantteooriata mõeldamatud.
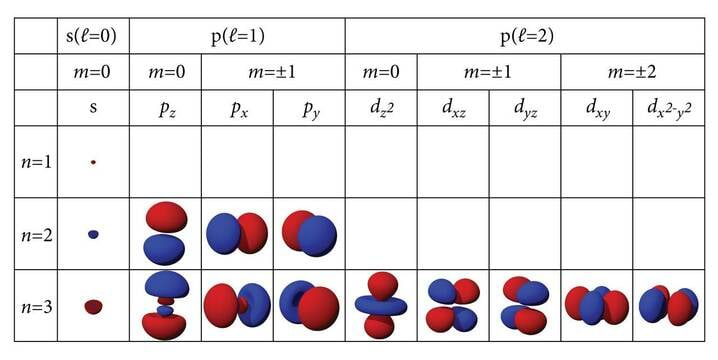
Jah, aatomit võib tänapäeval päris hästi kirjeldada, aga peab arvestama, et nägemisega pole siin kuigi palju pistmist. Elektronide asukohti aatomis kirjeldatakse kvantarvudega. Õigemini kirjeldatakse neid piirkondi, kus elektrone võib leida, st elektronide leiulainete kujusid. Tõrjutusprintsiipi võib makromaailmas seletada nii, et kaks keha ei saa olla samal ajal samas kohas. Aatomi elektronstruktuuris tähendab see, et samas olekus, st sama kvantarvude komplektiga saab aatomis korraga olla ainult üks elektron. Elektronide kvantarve on neli: peakvantarv (), orbitaalkvantarv (), magnetkvantarv () ja spinn ().
Peakvantarv loeb elektronkihte. Elektroni keskmine kaugus tuumast on väikseim esimeses kihis (). Järgmistes kihtides on elektronid tuumast keskmiselt järjest kaugemal. Leiulaine suuremad amplituudid on tuumast kaugemal, suurema tõenäosusega võib elektrone leida tuumast veidi kaugemal.
Kuna kaugemal on ruumi rohkem, siis mahub sinna rohkem elektrone ja alates teisest kihist () jagunevad elektronid alakihtidesse. Igas järgmises kihis on üks alakiht rohkem (alakihte vastavas elektronkihis loendatakse nullist peakvantarvuni, ). Lõplikult määrab elektroni poolt kasutatava territooriumi magnetkvantarv. Magnetkvantarvu väärtused igas alakihis võivad olla . Magnetkvantarvule lubatud pluss- ja miinusväärtused annavad igas järgmises alakihis ruumi veel kahele elektronile. Tuumast kaugemates kihtides võib olla üha rohkem elektrone, sest alakihte on rohkem ja eriti seepärast, et iga järgmine alakiht mahutab rohkem elektrone.
Lisaks on elektronil veel üks omadus, spinn. Spin tähendab inglise keeles pöörlemist ja tihti kujutataksegi elektroni päri- või vastupäeva pöörleva kerakesena. See on liiga piltlik, et olla täpne, aga aatomi elektronstruktuuri kirjeldades võib küll öelda, et ühele leiulainele vastab kaks elektroni, nende spinnid on vastassuunalised. Kokku on igas kihis kohta elektronile.
Perioodtabeli koostamise aegu järjestati elemendid aatommasside järgi ja nii said nad endale järjenumbrid. Tegelikult kajastab järje- ehk aatomnumber (Z) elektronide arvu aatomis ja ühtlasi tuuma elementaarlaengute arvu. Elektronkatte kihiline ehitus võimaldab kaugemates kihtides hoida rohkem elektrone. Esimese (tuumale lähema, alumise, kõige sügavama, väiksema energiaga) kihi peakvantarv on üks () ja sinna mahub kaks elektroni. Arvestades ka spinni mahub igasse kihti elektroni. Esimeses perioodis ongi kaks elementi, sellega on esimene kiht täis ja täituma hakkab teine. Teise kihi peakvantarv on 2, sinna mahub 8 elektroni. Aatomite keemilisi omadusi määravad väliselektronid. Heeliumil ja neoonil on väliskihid elektrone täis ja nende keemilised omadused on väga sarnased. Pole uudiseks, et kui väliselektrone on vähe, on need nõrgalt seotud ja aatomid kalduvad neid loovutama. Kui aga väliskiht on peaaegu täitunud, täituvad allesjäänud kohad kergesti teistelt aatomitelt saadaolevate elektronidega. Väliselektronid on sidemete moodustumise alus. Keemiliselt kõige põnevamad on nelja väliselektroniga aatomid, nagu süsinik ja räni, mis oma nelja võimaliku sidemega pakuvad võimaluse lõputu arvu ühendite tekkimiseks. Paljude elektronidega aatomites muutub üha olulisemaks elektronide omavaheline mõju ja alates neljandast perioodist läheb kihtide järjestikuse täitumise reegel segamini. Neljandasse kihti läheb esimene elektron enne, kui kolmandas on kõik võimalikud kohad hõivatud.
| Joonis 2.2.7. Elektronide tõenäosuslikku paigutust aatomi sees on võimalik välja arvutada ja katseliselt kinnitada. Kas on võimalik ka tõeliselt elektronkattesse piiluda või vähemalt otse aatomite seest pärinevaid andmeid pildiks muuta? 2013. aastal avaldas rahvusvaheline teadlaste rühm pildid, kus väidetavalt esimest korda paistab ergastatud vesiniku aatomi elektronstruktuur. Kasutatud on uut „kvantmikroskoopi”, kus toimib juba 30 aastat tagasi välja pakutud fotoionisatsioonmikroskoopia meetod. Laseriga ioniseeritavast aatomist erinevates suundades väljuvad elektronid suunatakse elektrivälja abil läbi elektrostaatilise läätse ekraanile. Tekkinud elektronlainete interferentsipilt kannab otsest infot elektronide leiulainetest. | Kass riputab üles perioodilisustabeli |
J. J. Thomson oli tuntud briti füüsik, andekas õpetaja ja hinnatud lektor. Õpetamine ja juhendamine on kindlasti üks tema suuremaid teeneid füüsikateadusele. Tal oli palju õpilasi ja assistente, koguni seitse neist on saanud Nobeli preemia. Aatomimudelite peatükis on juba mainitud Niels Bohri, aatomituumast rääkides tuleb paratamatult alustada Ernest Rutherfordist ja tuumarelva teemas meenutame Robert Oppenheimerit. Kõik nad õppisid ja töötasid Thomsoni laboris ja kes vähegi huvitub aatomifüüsika ajaloost, kohtab seal veel palju teisi tema õpilasi ja kaastöötajaid. Thomson ise sai Nobeli preemia 1906. aastal gaaside elektrijuhtivuse uurimise eest. Gaasi läbiva elektrivoolu eksperimendid olid tõesti olulised, neist koorus lõpuks välja elektron, mis aitas mõista elektrivoolu olemust ja pikapeale hakkas sealt ka aatomi siseehitus hargnema. Hiljem uuris Thomson positiivsete laengukandjatega (ioonidega) elektrivoolu ja teda peetakse stabiilsete elementide isotoopide avastajaks ning ühtlasi mass-spektromeetria leiutajaks. Nobeli preemia sai 1937. aastal ka J. J. Thomsoni poeg George Paget Thomson uurides katseliselt elektronide difraktsiooni kristallides ja tõestades sellega elektroni laineomadusi (ptk Elektronide difraktsioon).
Louis de Broglie, Prantsuse aadliperest pärit noormees, õppis Sorbonne’is ajalugu ja valmistus diplomaadikarjääriks. Ülikooli lõpetamise ajaks tekkinud huvi matemaatika ja füüsika vastu viis teda kõhkluste kiuste edasi õppima loodusteadusi. Esimese maailmasõja ajal teenis de Broglie Eiffeli torni raadiojaamas ja kulutas kogu vaba aja tehnilistele probleemidele. Pärast sõda jätkusid füüsikaõpingud, põhihuvi oli pöördunud kvantide teooriale. 1924. aastal kaitstud dissertatsioonis „Uuringud kvantteoorias” avaldas de Broglie mateerialainete idee, mille järgi teda kõige enam tuntakse. Võib öelda, et kui Planck ja Einstein kvantiseerisid kiirguse, mis nii kindlat tundus olevat laineline, siis de Broglie sai hakkama vastupidisega. Ta omistas laineomaduse aineosakestele, kõigepealt elektronidele. 1927. aastal kinnitasid de Broglie teooriat mitu teaduseksperimenti. 1929. aastal sai ta Nobeli preemia elektronide lainelise olemuse avastamise eest. Selsamal teemal peetud nobelisti loengus ütleb ta: „Kuigi osakesed ja lained ei saa olla sõltumatud, sest Bohri järgi moodustavad nad tegelikkuse kaks üksteist täiendavat jõudu, peab ometi olema võimalik tuvastada teatud paralleelsust osakese liikumise ja sellega seotud laine liikumise vahel.” De Broglie arendas hiljem lainemehaanikat tuumafüüsikas, aga jäi selle juurde, et osakeste laineomadusega kaasneb mingi reaalne, kuigi osakesest lahutamatu lainetus. Ta hindas kõrgelt füüsika üldist filosoofilist pilti ja kirjutas sel teemal mitu populaarset raamatut.