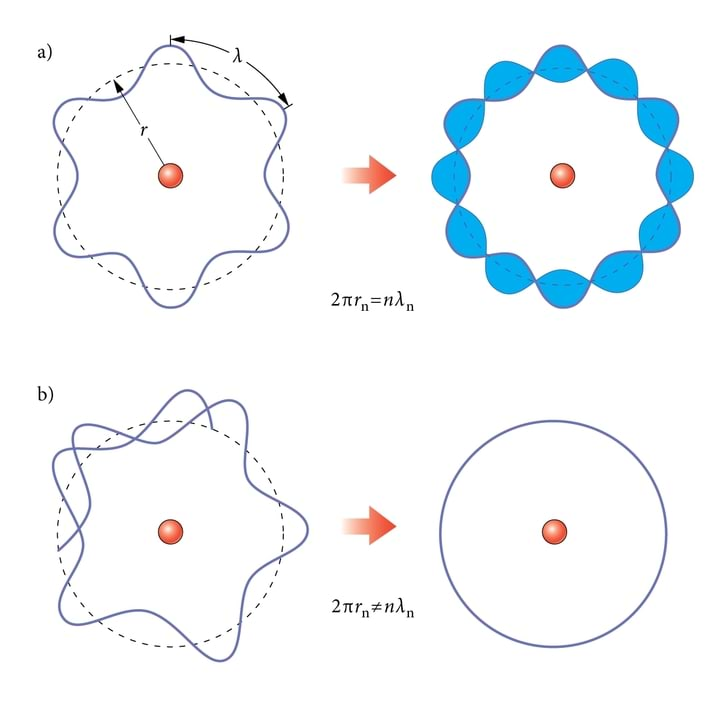
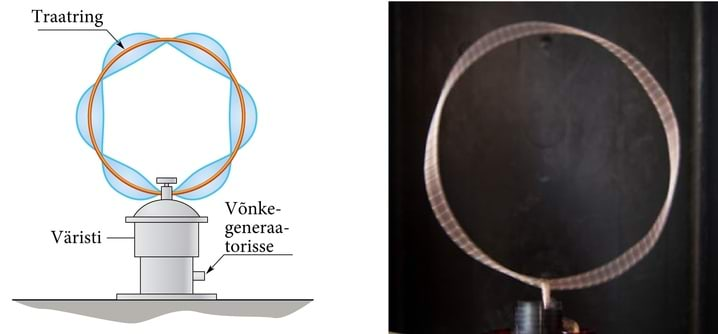
Elektroni leiulaineid ei sulusta aatomisse muidugi mitte kujuteldava karbi seinad, vaid elektrilised tõmbejõud tuuma ja elektroni(de) vahel. Astume sammu karbimudelilt tegelikkusele lähemale ja üritame sobitada elektroni laineloomust aatomi planetaarmudeliga. Vaatame lihtsaimat, vesiniku aatomit ainsa elektroniga ringorbiidil raadiusega (joon. 7.4). Kui elektron tiirleb orbiidil, peavad tema leiulained olema orbitaallained, s.o. tiirutama orbiiti pidi ümber tuuma. Elektroni statsionaarsetele, püsiseisunditele vastavad seisulained.
Otsteta ringil saavad orbitaallaineist tekkida seisulained ainult siis, kui laine ringeldes end lakkamatult kordab (joon. 7.4). Selleks peab ringile sobituma parajasti täisarv laineid:
Asendades de Broglie’ valemist (4.1 ), saame
ehk
kus tähistasime, nagu kvantfüüsikas tavaks,
on elektroni mass, – tema kiirus. (Meenutame mehaanikakursusest, et mvr on tiirleva elektroni pöördimpulss e. impulssmoment.) Seega on orbiidi raadius ja elektroni orbitaalkiirus , siis ka energia, vastastikuses sõltuvuses. Avaldades valemist (7.6 ), näeme et püsiseisundeile sobivad üksnes
kus kvantarvuks on n=1,2,3....
Elektroni laineomadused ja orbiidid
Seega järeldub elektroni laineloomusest, et ta võib tuuma ümber tiirelda vaid teatud kindlatel orbiitidel raadiusega rn .
Valemi (7.6 ) avaldas 1913. a. esimesena üks maailma tippfüüsikuid, taanlane Niels Bohr (l. nils boor). Tollal ei teadnud ta midagi elektroni laineomadustest. Toetudes vaid intuitsioonile ning soovides seletada aatomi püsivust ja spektraalseeriaid, ta lihtsalt postuleeris (ld. k. postulare - nõudma), et lubatud orbiitidel, mille raadius rahuldab seost (7.6 ), elektronid ei kiirga, kuigi tiirlevad (Bohri I postulaat). See oli muidugi järsus vastuolus makrofüüsika seadustega ja kohtas füüsikkonnas laialdast umbusku. Kuid nõnda õnnestus Bohril “päästa” planetaarmudel kiirgusvaringust (vt. alajaotus 1.2). Sündis uus, Bohri aatomimudel (joon.7.7 c), mis on mänginud mikrofüüsika arengus väga tähtsat osa. Lainesisu (vastavalt valemeile (7.5 ) ja (7.7 )) andis sellele postulaadile 10 aastat hiljem L. de Broglie.
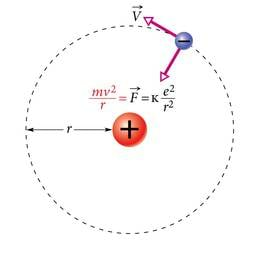
Kesktõmbe- e. tsentripetaaljõuksjõuks , mis hoiab elektroni tuuma ümber tiirlemas, on elektrijõud tuuma ja elektroni vahel (joon. 7.6). Coulombi seaduse järgi
kus on elementaarlaeng, ja elektriline konstant. Teatavasti kesktõmbekiirendus
Rakendades Newtoni II seadust , saame
Seega
kust saab arvutada orbiitidele raadiusega rn vastavad energiatasemed . Tulemuseks on
Miinusmärk johtub sellest, et nullnivooks loetakse elektroni potentsiaalne energia, kui ta on tuumast eemaldatud lõpmata kaugele. Joonisel 7.7 on valemi (7.9 ) järgi arvutatud energiatasemete skeem.
Bohri II postulaadi järgi kiirgab või neelab aatom valgust ainult elektroni hüpetel lubatud orbiitide vahel (joon.7.7), kusjuures tekivad või kaovad footonid energiaga
kus on mingi kõrgema ja madalama taseme energia.
Vastaku kõrgemale tasemele kvantarvu väärtus , madalamale n=n1. Siis, asendades ja (7.9 )-st, saame
ehk, kuna λf=c,
Võrreldes äsja leitud valemit (7.12 ) p. 3 toodud Balmeri-Rydbergi valemiga (3.1 ), mis saadud katses mõõdetud spektrite töötlemisel, näeme oivalist kokkulangevust. Järelikult kirjeldab Bohri - de Broglie’ aatomimudel vesiniku aatomit päris hästi. Ta selgitab mitte üksnes vesiniku joonspektrite tekkepõhjust ja struktuuri, vaid näitab õigesti kätte ka joonte lainepikkused.
Huvilistele, kes väikest rehkendust paljuks ei pane, toome ära ka valemi (7.9 ) tuletuskäigu. Lähtume avaldistest (7.7 ) ja (7.8 ). Avaldame neist rn. Mugavamaks teisendamiseks viime (7.8 ) kujusse
Siit, avaldades m2v2n (7.7 )-st,
millest
Elektroni koguenergia -dal statsionaarsel orbiidil rn liitub tema kineetilisest energiast Ekin=mv2n/2 ja potentsiaalsest energiast tuuma elektriväljas, mis avaldub kuju Epot=−ke2/rn:
Võrrandist (7.8 ) leiame
seega
Teisendades avaldist (7.7 ), saame
Asetades vn sel kujul valemisse (7.8 ), osutub, et
Asendades rn (7.13 )-st leitu koguenergia valemisse, tuleb välja
ehk
Asendades konstandid , , ja nende arvväärtustega, saamegi valemi (7.9 ).