Antoine Lavosier tegi 1772. aastal hirmkalli eksperimendi. Ta koondas päikesekiired hapniku keskkonda paigutatud teemandile ja põletas selle ära. Selle reaktsiooni ainsaks saaduseks oli süsihappegaas. 18. sajandi lõpuaastateks oli katset nii palju korratud ja täiustatud, et Smithson Tennant võis teatada tavalise söe ja teemandi keemilisest samasusest. Põlemisel andsid võrdsed söe, tahma, grafiidi ja teemandi kogused võrdse mahu süsihappegaasi. Vaadates või katsudes korraga briljanti ja söetükki, tundus nende keemilise identsuse idee äärmiselt kahtlane.
Ometi leppisid teadlased pikapeale tõsiasjaga, et teemant ei sisalda lisaks süsinikule mingeid tundmatuid elemente. Sellega oli lahti tee kunstteemantide tootmiseks. Kohe selle kallale asutigi ja vähem kui saja aasta pärast andsid esimesed leiutajad teda, et grafiiti on võimalik muuta teemandiks mitmel erineval moel. Kahjuks korduskatsed ei õnnestunud ja tehisteemantide tegeliku tootmiseni kulus veel aastakümneid. Lisaks teemantide tootmise tehnoloogiale kuuluvad 20. sajandi saavutuste hulka süsiniku teisendid, mille olemasolust ja tootmise võimalusest ei osatud unistadagi: fullereenid, süsiniknanotorud, grafeen jt. Millised on need aine ehituse saladused, mis tuli teadlastel lahendada, enne kui teemandikaevandamise kõrvale tekkis teemanditootmine ja süsinikmaterjalide nanotehnoloogia?
Aine kolm olekut – tahke, vedel ja gaasiline - on tuttavad meile kõigile. Kuumutamisel muutuvad tahked ained vedelaks, edasisel kuumutamisel lähevad keema ja aurustuvad. Üldiselt see nii ongi, aga isegi igapäevaste loodusnähtuste jälgimisel võib märgata teatud kõrvalekaldumist sellest lihtsast reeglist. Vesi, lihtne, aga väga eriline aine, käitub selles mõttes väga viisakalt. Tavapärastel temperatuuridel esineb vesi tõesti kolmes olekus. Temperatuuri tõusu järjekorras: jää, vesi ja veeaur. Jääd ja vedelat vett teame kõik hästi, auruga on veidi keerulisem. Kuna veeaur on nähtamatu, st vaatlemisel õhuga täiesti sarnane, siis me kipume aurustumisega kaasnevat udu (väikeseid veepiisku) tihti veeauruks nimetama. See pole küll terminoloogiliselt ega sisuliselt õige, aga „kus udu, seal auru”, nii et teatud seos on siin olemas. Üks kõrvalekalle lihtsast kolme oleku mudelist on see, et vesi aurustub ka ilma keemiseta. Kui veeklaas lauale jätta, on see olenevalt tingimustest mõne päeva või mõne nädalaga tühi. Vähe sellest, jää võib ka ilma vedelaks muutumata „ära aurata”. Kui märg pesu talvekülmaga nöörile riputada, siis kuivab see tuule käes ära vaatamata sellele, et algul kõvaks külmub. Seda nähtust nimetatakse sublimeerumiseks. Jääkristallide sublimeerumine ei ole küll nii igapäevane nähtus kui vedela vee aurustumine, aga hea tahtmise juures täiesti märgatav ja mõõdetav. Paistab, et isegi lihtsate ainete korral tekib küsimusi. Kes on näinud vedelat süsihappegaasi või gaasilist süsinikku? Miks on ainete sulamis- ja keemistemperatuurid nii erinevad?
Aine oleku ja ülemineku ühest olekust teise määravad suures osas molekulaarjõud. Nagu me teame, hoiavad aatomeid molekulides keemilised sidemed. Aatomitevaheliste sidemete pikkused ja nendevahelised nurgad molekulis panevad olulises osas paika aine keemilised ja füüsikalised omadused. Keemilised sidemed, mida põhjustab laetud osakeste vaheline elektromagnetiline vastastikmõju, on üsna tugevad. Lisaks toimib aatomite ja molekulide vahel veel teisi, palju nõrgemaid jõude.
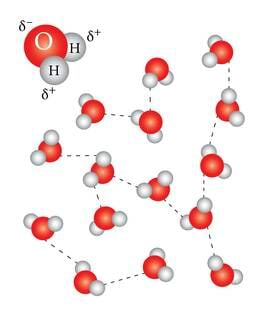
Molekulid kipuvad omavahel tõmbuma, kui nad üksteisele piisavalt lähedale satuvad. Tõmbumise põhjuseks on molekulide polaarsus. Aatomid on küll tervikuna elektriliselt neutraalsed, aga molekuli moodustades ei jaga nad elektrone ühtlaselt. Seepärast on paljud molekulid polaarsed, ühest kohast positiivse, teisest negatiivse laenguga (joonis 1.1.1.). Isegi molekulides, kus laengud on jagatud ühtlaselt, võivad elektronid ajutiselt ümber paikneda. Sellest tekib molekulide ajutine polariseerumine. Sama molekuli erinevate aatomite juures indutseeruvad erinimelised laengud, mille kaudu molekulid üksteist mõjutavad. Neid molekulidevahelisi, suhteliselt nõrku mõjusid nimetatakse van der Waalsi jõududeks.
Vesinikside. Ühendites, kus vesinik on seotud hapniku, lämmastiku või fluoriga (rühmad -OH, -NH ja -FH), on vesinikul positiivne osalaeng ja sideme teisel poolel negatiivne osalaeng. Selliste molekulide vesinikule kontsentreerunud positiivne laeng moodustab täiendavaid sidemeid teiste molekulide negatiivselt laetud aatomitega. Neid sidemeid kutsutakse vesiniksidemeteks. Vesiniksidemed võivad tekkida molekulide vahel. Näiteks moodustavad vee molekulid omavahel palju vesiniksidemeid, mis ongi suures osas vee väga eriliste omaduste põhjuseks. Vesiniksidemed võivad tekkida ka suurte molekulide sees, hoides biomolekule vajalikul viisil kokkupakituna. Vesiniksidemed on piisavalt tugevad, et molekule üksteisega seotuna hoida, samas piisavalt nõrgad, et elukeskkonna tavapärastel temperatuuridel katkeda. Sel moel on vesiniksidemed bionähtustes väga olulised. Vesiniksidet võib vaadelda kui teatud vahepealset nähtust molekulaarjõudude ja keemilise sideme vahel.
Hollandi füüsikateoreetiku, Amsterdami ülikooli esimese füüsikaprofessori Johannes Diderik van der Waalsi põhihuvi oli suunatud termodünaamikale. Tema nime kannavad peale jõudude veel reaalgaase kirjeldav van der Waalsi võrrand (Nobeli preemia 1910), mitmest molekulist koosnevad, molekulidevaheliste jõududega seotud van der Waalsi molekulid ja aatomite mõõtmeid kirjeldavad van der Waalsi raadiused. Eraldi väärib mainimist tema kapillaarsuse (ptk 1.7.) termodünaamiline teooria 1893. aastast, mis tekitas vaidlusi, sest molekulide ja soojusliikumise olemasolu ei olnud selleks ajaks veel üldiselt tunnustatud.
Aine kogust (üht tükki ainet), mis on kogu tervikuna samade füüsikaliste omadustega, nimetatakse faasiks. Vaatleme näiteks klaasitäit vett jääkuubikutega. Kuigi jää ja vesi on keemiliselt sama aine, on nende füüsikalised omadused ilmselt erinevad. Jää ja vesi on omakorda klaasis. Jääkuubikutega vees on: A) jääkuubikud, tahke faas; B) vesi, vedel faas, C) klaas, teine tahke faas, D) kui see kõik asub õhus, tuleb juurde veel gaasiline faas. Kõikide faaside vahel on piirpinnad, kus õhukeses kihis toimuvad pinnanähtused. Selge, et vee ja jää pinnakihis toimub sulamine, vee ja õhu piirpinnal aurustumine. Samas võib jää ja vee piirpinnal toimuda hoopis tahkumine, kui temperatuur on piisavalt madal. Vee ja õhu piirpinnal võib toimuda lisaks aurustumisele ka kondenseerumine ja gaaside lahustumine. Ka klaasi ja vee või klaasi ja õhu piirpinnal toimuvad teatud nähtused. Näiteks lahustuvad mõned klaasi komponendid vähesel määral vees. Kui vesi ei ole päris puhas, adsorbeeruvad lahustunud ained klaasile.
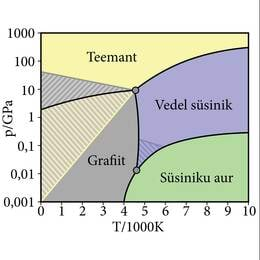
Kõigis neis näidetes on faasidevaheline piirpind ühtlasi erinevas olekus ainete piirpinnaks. Kuid esineb ka seda, et erinevad faasid moodustuvad samast ainest samas olekus. Kõige tuntum mitme tahke faasiga aine on süsinik, seda eelkõige tänu oma kahe loodusliku teisendi, grafiidi ja teemandi täiesti erinevatele füüsikalistele omadustele (ptk Faasidiagramm). Veelgi lisavad süsinikule kuulsust kunstlikult loodud teisendid (uued faasid), fullereen, grafeen jt.
Tahkete faaside eripära on kuju. Tahked kehad avaldavad vastupanu deformatsioonile, vedelikud ja gaasid seda ei tee. Samas on vedelatel ja tahketel faasidel ka ühiseid omadusi, näiteks kindel ruumala, mida ei ole jälle gaasidel. Seepärast kannavad tahked ja vedelad faasid ühist nimetust, kondensaine. Gaaside ja vedelike ühine omadus, kindla kuju puudumine, tingib nende voolavuse. Seepärast on nende ühine nimetus voolis. Esineb ained ja ainete segusid, kus selline lihtne sildistamine ei tööta kuigi hästi. Näiteks väga viskoossed vedelikud ja puisteained kipuvad tihti käituma kuidagi vahepealselt.
Aatomid, keemilised sidemed ja molekulide struktuur määravad ainete omadusi. Samas on paljud nähtused ja protsessid, mis ainetega toimuvad (olekute muutused, lahustumine, osmoos, pindpinevus), juhitud molekulaarjõududest. Molekulaarnähtuse hulgas on erilisel kohal see, mis toimub faaside piirpinnal, aine või faasi pinnakihis. Tuntuimad pinnanähtused on märgamine ja kapillaarsus, mis seostuvad vee ja teiste vedelike pinnakihi erilise omaduse, pindpinevusega (ptk Pindpinevus).
Mainime veel, et sõnal „faas“ on muidki tähendusi. Võnkumiste ja lainete, ka elektromagnetlainete, kirjeldamisel, astronoomias, meditsiinis, bioloogias ja materjalide töötlemisel on „faasil“ hoopis teised tähendused.
Esmapilgul tundub sulamine olevat lihtne nähtus. Vaatame, kuidas jääkuubikud vees sulavad. Jää sulamistemperatuur ja vee tahkumistemperatuur (jäätumistemperatuur) on 0°C. Samuti on jäätükkidega vee temperatuur null kraadi. Igapäevaselt tähendab see, et kui nullkraadine jäätükkidega veeklaas jätta lauale tasapisi soojenema, siis nii kaua, kuni jääd veel on, ei lähe jäätükkide vahel olev vesi soojemaks. Soojushulk, mis soojast toaõhust vette ja jäässe üle kandub, kulub jää sulatamiseks, mitte vee soojendamiseks.
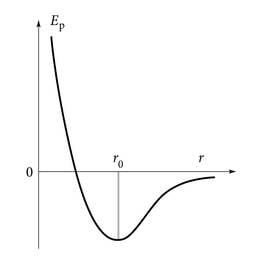
Tahkes olekus (näiteks kristallides) on molekulide (aatomite, ioonide) asukohad üksteise suhtes määratud keemiliste sidemete pikkuste ja sidemete asenditega. Öeldakse, et selline tahkis on atomaatselt korrastatud struktuuriga. Samas on molekulidele iseloomulik pidev, korrapäratu, kaootiline, juhusliku loomuga liikumine, mida nimetatakse soojusliikumiseks. Nii ei ole ka tahkes olekus molekulid omal kohal päris paigal. Piltlikult võib seda kujutada kui aatomite juhuslikku rabelemist talle määratud koha ümber. Molekule ja kristallvõret joonistades või vastavaid mudeleid kokku pannes kujutatakse aatomeid ainult lihtsuse mõttes paigalseisvate kerakestena. Aatomitevahelise kauguse määrab siin ära potentsiaalse energia miinimumi printsiip. Aatomid asuvad üksteisest keskmiselt sellisel kaugusel, kus neil on „kasulik” olla, kus nendevahelise seose energia on kõige väiksem (joonis 1.1.3.).
Igapäevaelukogemustest on hästi teada, et sulatamiseks on vaja energiat kulutada, st ainet on vaja soojendada. Energia jäävuse seadus ütleb, et ainete tahkumisel peab sama suur kogus energiat eralduma. Näiteks 1 kg alumiiniumi sulatamisel tuleb kõigi aatomite potentsiaaliaugust (joonis 1.1.3.) väljatoomiseks teha kokku 321 kJ tööd. Seda kokkulepitud ainekoguse (ühikulise massi) sulatamiseks kuluvat soojushulka nimetatakse sulamissoojuseks. Kui sulaalumiinium vormi valatakse ja tahkuda lastakse, siis lähevad aatomid jälle oma minimaalse energiaga kohtadele tagasi (kaugus üksteisest r0) ja sulatamiseks kulutatud soojushulk eraldub. Tahkumisel eralduvat soojust on võrreldes sulamiseks kuluvaga raskem märgata. Tundub üsna loogiline küsida, kas tõesti kinnikülmuv järv soojendab jääkristallide moodustumisel vabaneva energia arvel iseennast ja ilma. Kuigi see võib intuitiivselt paista veidi kahtlane, siis just nii see ongi. Veekogud saavad külmuda ainult siis, kui õhk on piisavalt külm, et tahkumisel eralduv soojushulk vastu võtta ja ära kanda.
Selline sulamist kirjeldav molekulaarmudel on õige mitmetel lihtsatel juhtudel, aga tegelikult on palju aineid ja suur hulk nähtusi, kus sulamise ja tahkumise kirjeldamine on hoopis keerulisem.
Näiteid pole vaja kaugelt otsida. Mitmed ained esinevad ainult gaasi ja tahkisena. Süsihappegaas, nagu nimetuski ütleb, on tuntud enamasti gaasina. Tahket süsihappegaasi on võimalik valmistada nii süsihappelume kui kuiva jääna, aga vaevalt on keegi näinud vedelat süsihappegaasi. Kuiv jää normaalrõhul ei sula, vaid muutub gaasiliseks ilma vahepealse vedela olekuta ehk sublimeerub (ptk Faasidiagramm).
Segude (näiteks sulamite) sulamisel ja eriti tahkumisel sõltub palju komponentide vahekorrast ja temperatuurimuutuse kiirusest. Metallide tehnoloogias on teadmised neist protsessidest väga olulised. Näitena meenutame, kuidas muudab raua tahkumist ja saadud materjali omadusi mõneprotsendiline süsinikusisaldus (teras, malm) või jahtumisrežiim (karastamine).
Kuigi üldiselt on sulamis- ja tahkumistemperatuur võrdsed, on võimalik ka vedelike allajahtumine. Näiteks puhta vee temperatuur võib langeda alla null kraadi, ilma et jääkristallid tekiksid. Paistab, et jäätumine ei „suuda otsustada”, kuhu tekib esimene kristallike. Sellise vedeliku paneb kiiresti tahkuma vähimgi häirimine, nt loksutamine või lisandid. Samamoodi võib aur alla jahtuda. See juhtub tihti veeauruga atmosfääris ja on oluline nähtus pilvede tekkimisel (ptk Kastepunkt. Ilm ja kliima).
Kristalsetel ainetel on olemas kindel sulamistemperatuur. Aga on olemas hulk amorfseid aineid, mis muutuvad vedelikuks teatud temperatuurivahemikus ja ka nende tahkumine ei sarnane sugugi vee jäätumisega. Näidetena väärivad eelkõige nimetamist pigi, vaha, termoplastilised polümeerid ja klaas. Klaas on nende hulgas nii eriline ja oluline, et sellele sarnaseid, molekulaarstruktuurilt korrastamata ja seepärast ka täpse sulamistemperatuurita aineid nimetataksegi tihti klaasideks. Kuumutamisel muutuvad klaasid algul pehmeks ja temperatuuri tõusuga viskoossus väheneb, kuni saabub üsna tavalise vedeliku sarnane olek. Seepärast võib öelda, et klaasidel sulamistemperatuuri ei ole.
Tuleb siiski märkida, et on mitmeid omadusi (soojuspaisumine, erisoojus), mis klaasi sulatamisel muutuvad palju järsemalt kui viskoossus. Temperatuuri, mille juures mingi füüsikaline omadus järsult muutub, nimetatakse siirdetemperatuuriks.
Olek ei pea siirdetemperatuuril järsult muutuma. Nagu me kõik klaasi näite varal teame, on amorfsed materjalid siirdetemperatuurist oluliselt madalamal temperatuuril vägagi kristalsete ainete sarnased. Külma ilmaga võib pigi haamriga kildudeks lüüa, kuigi kuumal suvepäeval kipub ta laiali valguma. Mitmed igapäevastel temperatuuridel elastsed või plastilised ained muutuvad külma käes ootamatult hapraks. Näiteid võib leida nii igapäevaelust kui kosmosetehnikast.
Klaasi amorfsete omaduste tõestuseks kirjeldatakse tihti väga vanade aknaklaaside alumise serva paksemaks vajumist. Kuna klaasil on omadusi, mis lubavad teda pidada mitte kristalseks aineks, vaid väga suure viskoossusega vedelikuks, siis sadade aastatega võiksid aknaklaasid tasapisi allapoole voolata ja alt paksemaks muutuda. Tegelikult ei ole selle nähtuse esinemise kohta selgeid tõendeid. Vanad aknaklaasid on tõepoolest enamasti alt paksemad. Samas ei ole kusagil märgatud raamidest väljavajumist ja muid nähtusi, mis peaksid ilmnema viskoosse vedeliku valgumisel. Miks on siis keskaegsed kirikuakende klaasid alumisest servast paksemad?
Erinevad klaasisordid on erineva keemilise koostisega ja nende füüsikalised omadused on erinevad. Klaasi pehmenemise temperatuurivahemik on sorditi erinev. Kuumuskindlad sordid ja optiline klaas on selles mõttes sarnasemad kristallidega, akna- ja pudeliklaas käitub laiemas temperatuurivahemikus viskoosse vedelikuna. Tootmise ja klaasikunsti, eriti klaasipuhumise jaoks on see omadus oluline. Näiteks kroonklaasi meetodi etappideks olid suure anuma puhumine, lahtilõikamine ja selle klaaskettaks vormimine. Peaaegu vedelast klaasist puhutud pudeli põhi on lahti lõigatud ja kiire pöörlemise tulemusel venib ikka veel poolpehme klaas üha suuremaks, tasasemaks ja õhemaks kettaks. Tehnoloogia ja klaasisordi nimi tulevad sellest, et pudelist siledaks kettaks venimisel on toorik vahepeal kroonikujuline. Saadud ketas lõigatakse pärast ettevaatlikku jahutamist tahvliteks. Seejuures on hea, kui klaas püsib laiemas temperatuurivahemikus pehme ja vormitav. Saadakse üsna suured klaaskettad, mis on paratamatult keskelt paksemad kui servast. Nende tahvliteks lõikamisel saadud aknaklaasi üks serv või nurk jääb paksem. Tuleb tunnistada, et me ei tea, miks ehitajad paigaldasid klaasi alati või vähemalt valdavalt paksema servaga allapoole, aga on üsna selge, et just nii nad tegid. Ka kõigis muudes kohtades peale akende, kus vana klaasi on leitud, ei ole märgata voolamisega sarnanevat deformatsiooni. Näiteks maa seest või varemete alt välja kaevatud klaasesemed ei ole sajanditega kuidagi pinnase või kivide survele järgi andnud. Klaas on igapäevase õhutemperatuuri juures ikkagi lihtsalt tahke aine.
Sulamistemperatuuri määramiseks on mõistlik võtta võimalikult väike ainekogus (peenikeses torus, õhukese kihina) ja lasta temperatuuril aeglaselt tõusta, jälgides samal ajal ümbritseva keskkonna temperatuuri. Sulamise hetke on kerge märgata, muutus on selgelt näha. Samuti on võimalik mitmesuguste anduritega registreerida aine optiliste või soojuslike omaduste muutust sulamise hetkel ja salvestada samal hetkel temperatuurinäit.
Lihtsas sulamistemperatuuri määramise seadmes on elavhõbetermomeetri reservuaari külge on kinnitatud peenikeses klaasist torukeses (d≈1 mm) peenestatud aine. Termomeeter on pannakse õliga täidetud anumasse, Thiele katseklaasi, mida gaasipõletiga aeglaselt kuumutatakse. Sulamistemperatuuri vaadatakse hetkel, kui aineproov muutub läbipaistvaks, st vedelaks.
Aine olekud, keemilised sidemed, molekulaarijõud
Aine olekud ja olekumuutused on määratud keemiliste sidemete ja molekulaarjõudude iseloomuga.
Tahkis
In solids (solid bodies), the particles of matter are close together. In the solid state, the kinetic energy of the particles of matter is much smaller than the potential energy of the attractive forces acting between the particles. The peculiarity of solids is revealed by deformation: only solids resist deformation. The common property of liquids and solids is the conservation of volume, which is why they are called condensates.
Kõik me oleme kunagi oodanud, et vesi kannus keema läheks. Teame, et temperatuuri tõusuga kaasneb kõigepealt kiirem aurustumine, molekulid hakkavad veepinnalt üha rohkem lahkuma. Muidugi aurustub veidike ka külm vesi – kuna molekulide soojusliikumise kiirused on erinevad, siis leidub alati osakesi, millel on juhuslikult piisavalt liikumisenergiat, et pinnakihist välja pääseda. Vee all, pinnast kaugemal võib samuti olla lahkumiseks piisavalt kiireid molekule. Kui neid on vähe, siis nad välja ei pääse, sest kaotavad aeglasemate molekulidega põrkudes kiiruse.
Aurustumisel pöördub osa molekule pidevalt õhust vette tagasi. Selle tulemusena on veepinna kohal õhk püsivalt niiske, st sisaldab veidi veeauru (ptk Õhuniiskus). Temperatuuri tõusuga saavad vee molekulid hoogu juurde ja hakkavad üha enam veepinnalt lahkuma. Kuid see pole veel keemine. Keemistemperatuuril on kiireid molekule juba nii palju, et intensiivne aurustumine algab kogu vedelikus, mitte ainult pinnal. Tekivad aurumullid, mis kiiresti pinnale tõusevad, vesi on keema läinud. Kuni vett kannus veel on, temperatuur ei tõuse, selles mõttes on keemine sarnane sulamisega (ptk Molekulid. Tahkis).
Mõnikord, kui puhast vett kuumutatakse väga ühtlaselt, ilma segamata (näiteks mikrolaineahjus), võib temperatuur tõusta veidi üle keemistemperatuuri ilma aurumullide tekkimiseta. Kui sellist ülekuumutatud vedelikku veidi liigutada, algab keemine väga äkki. Pliidil ülekuumutatud vett teha ei saa, sest alt soojendamine põhjustab konvektsiooni, segab vett pidevalt ja mullid hakkavad tasapisi tekkima nõu kuumal põhjal.
Vee keemistemperatuur valiti juba väga ammu meie igapäevaselt kasutatava praktilise temperatuuriskaala (Celsiuse skaala) üheks aluseks, kindlaks punktiks. Arvatavasti just seepärast teavad kõik, et vesi keeb 100°C juures. Tegelikult sõltub vee keemistemperatuur üsna palju välisrõhust. Keemisel tekivad mullid saavad „ennast täis puhuda” ainult siis, kui aururõhk ületab välisrõhu. Teekannus on väliseks veele mõjuvaks rõhuks õhurõhk. See on küll veidi muutuv, aga igapäevasel teekeetmisel ei pruugi keemistemperatuuri muutuse pärast muretseda.
Mägedes, kus õhurõhk on oluliselt väiksem, tuleb toiduvalmistamisel arvestada, et vesi keeb madalamal temperatuuril. 6000-meetristele mägedele tõustes peavad alpinistid laagris toitu valmistades arvestama umbes 80°C juures keeva veega. Tõsiasja, et puhta vee keemistemperatuur lahtises anumas on otseselt seotud õhurõhuga ning selle kaudu ka päris rahuldavalt kõrgusega merepinnast (ja ka sügavusega allpool merepinda), kasutasid vanasti maadeavastajad ja loodusuurijad kõrguse määramiseks.
| Joonis 1.2.2. Keedunõus kaitseventiiliga kõrgendatud rõhku hoides on võimalik keeta vett kõrgemal temperatuuril kui 100°C. Survemahutis (autoklaavis) kaheatmosfäärilise rõhu all keeb vesi umbes 120°C juures. Sellist kõrgel rõhul ja temperatuuril keetmist kasutatakse steriliseerimiseks ja materjalide töötlemiseks. |
Keemistemperatuur. Siiani on jutuks olnud ainult vee keemine. Sobivatel tingimustel keevad ja moodustavad seejuures auru kõik ained, kui nad just kuumutamisel ei lagune. Keemistemperatuur ja selle sõltuvus rõhust on aine olulised füüsikalised omadused. Keemistemperatuuri atmosfäärirõhul on lihtne määrata. Seda muidugi juhul, kui aine üldse atmosfäärirõhul vedelas olekus esineb (ptk Molekulid. Tahkis). Kui vedelik keeb, st aurumullid tekivad ühtlaselt kogu nõus ja termomeeter näitab püsivalt ühte temperatuuri, siis ongi tegemist keemistemperatuuriga. Sulamistemperatuuri määramine on selles mõttes keerulisem, et alati peab kasutama hästi väikest ainekogust (ptk Molekulid. Tahkis).
Segude ja lahuste keemisel on olukord keerulisem. Lahuste keemistemperatuur on kõrgem kui puhtal lahustil. Selle põhjuseks on, et paljud lahustunud ained ei osale aurustumisel, ei lähe üle gaasilisse faasi (aurumullidesse). Lendumatu lahustunud aine aururõhku ei tekita. Keemiseks vajaliku välisrõhuga võrdse aururõhu saavutamiseks tuleb lahust kuumutada veidi kõrgemale temperatuurile. Lahuste keemistemperatuuri erinevus lahustite omast on huvitav nähtus. On selgunud, et keemistemperatuuri muutus sõltub ainult lahustunud osakeste kontsentratsioonist. Ei ole oluline, milline aine on lahustunud ja kas osakesed on ioonid, aatomid või molekulid.
Leidub päris palju kokandusnõuandeid, kus soovitatakse kindlasti lisada soola keeduvette, mitte hiljem valmistoidule. Väidetavalt tõstab soola lisamine keemistemperatuuri nii palju, et makaronid keevad kiiremini pehmeks. Jätame maitse-eelistused kõrvale ja küsime, kas keemistemperatuuri tõusust võib oodatud kasu olla?
Lahuste keemistemperatuuri tõus () sõltub lahuse molaalsusest (), lahusti omadusi kirjeldavast ebullioskoopilisest konstandist () ja isotoonilisest kordajast ().
Kui keeduveele lisada ühe liitri kohta 2 teelusikatäit soola (12 g), siis on saadud lahuse molaalsus 0,2 mol/kg. Vee ebullioskoopiline konstant on 0,512 K·kg·mol-1. Isotooniline kordaja kirjeldab aine lahustumisel tekkivate ioonide arvu, keedusoola korral .
Soola lisamisest saadav keemistemperatuuri tõus on tühine, toidu valmimise kiirust see ei mõjuta. Samas on muidugi võimalik, et mingid muud kaalutlused, maitse-eelistused, traditsioonid vms põhjendavad keedusoola koguse ja lisamise aja.
Lahustunud aineks on siin keedusool, mille sulamistemperatuur on 801°C ja keemistemperatuur 1413°C. Kuna vesi ja ka soolvesi keevad palju madalamal temperatuuril, kui keedusool sulab, siis võib öelda, et lahustatud on tahke aine. Täpsemalt, lahustunud aine oleks lahuse keemise temperatuuril tahke. See ei pruugi alati nii olla, näiteks vedelikud võivad lahustuda üksteises ja gaasid võivad lahustuda vedelikes. Isegi tahkes aines võib lahustuda gaas või vedelik.
Mõned vedelikud segunevad suvalistes vahekordades, näiteks vesi ja etanool. Teised ained moodustavad ühte nõusse valamisel selge piirpinna, näiteks vesi ja bensiin. Täpsemalt uurides selgub siiski, et piirpinnaga eraldatud vedelikud on mõlemad lahused. Bensiini ja vee näites on pealmises kihis bensiin, milles on lahustunud veidi vett ja allpool vesi, milles natuke bensiini. Kui segus on mitu piisavalt erineval temperatuuril keevat vedelikku, võib nende eraldamiseks või puhastamiseks üritada madalaima keemistemperatuuriga aine välja keeta. Seda meetodit nimetatakse destilleerimiseks. Lahustunud gaasid lahkuvad vedelikust muidugi ammu enne keemistemperatuurini jõudmist. Destillatsioon on oluline keemiatööstuse protsess ja just seepärast palju uuritud, teoreetiliselt ja tehnoloogiliselt hästi läbitöötatud. Vaatamata sellele peab ütlema, et vedelike eraldumine keemisel pole kõigis variantides sugugi lihtne nähtus.
| Joonis 1.2.3. Õli ja vesi lahustuvad üksteises väga vähe. Õli tihedus on väiksem kui veel, seepärast on õlikiht peal, vesi all. Samamoodi supipotis, rasvatilgad ujuvad supi peal. Muud lahustund ained jaotuvad kahe kihi vahel vastavalt sellele, kui hästi nad lahustuvad ühes või teises vedelikus. See võimaldab näiteks õlist ja kütustest mõningaid lisandeid välja pesta. | Joonis 1.2.4. Vedel lämmastik keeb. Kulbitäis veeldatud lämmastikku on anumast välja valatud ja keeb keemistemperatuuril. Lämmastiku keemistemperatuur on -196 °C (77 K), mis tähendab, et toatemperatuuril olev nõu on tema jaoks „väga kuum küttekeha”. Udu, mis keevat lämmastikku ümbritseb, tekib õhus leiduva veeauru kondenseerumisest (ptk 1.3.). |
Oleme kasutanud segamini mõisteid aur ja gaas. Tegelikult on muidugi iga gaas millegi aur. Näiteks väga madalal temperatuuril ja kõrgel rõhul gaasid veelduvad. Tavatingimustel veeldatud gaasid keevad. Lämmastik on meie atmosfääri põhigaas, teda on õhus kõige rohkem ja me räägime lämmastikust kui gaasist. Samas oleks täiesti korrektne ja teatud juhtudel isegi mõistlik rääkida vedela lämmastiku aurust.
Ained, mida me igapäevaselt nimetame tahketeks (metallid, soolad) sulavad siiski kõrgel temperatuuril, keevad ja aurustuvad. Gaasi ja auru mõisted on tavakeeles seotud sellega, mis olekus ainetega me igapäevaelus ja tehnikas kokku puutume. Näiteks halogeenid lihtainetena: räägime ja kirjutame nagu oleks kloor alati gaas, broom vedelik ja jood kristall. Seepärast on tavatingimustes juttu broomi ja joodi aurudest, aga samas kloorist kui gaasist.
Aine kolm olekut on küll selgelt erinevad, aga neil on paariti mõningaid sarnaseid omadusi. Gaaside ja vedelike ühiseks omaduseks on voolamine ja ainekoguse kindla kuju puudumine, nende ühine nimetus on voolis. Tahkised ja vedelikud on kindla tihedusega olekud, tihedus sõltub temperatuurist ja rõhust suhteliselt vähe. Tahkes ja vedelas olekus lahustuvad ained üksteises enamasti kindlates vahekordades, seepärast saame rääkida küllastunud lahustest, eutektilistest sulamitest ja aseotroopsetest segudest. Tahkiste ja vedelike ühine nimetus on kondensaine. Kuid just gaasiline olek on mõnes mõttes üsna eriline.
Gaasid segunevad kõigis vahekordades. Gaaside tihedus sõltub rõhust ja temperatuurist väga palju, nad on kokkusurutavad ja paisuvad. Ligilähedaselt on gaasi tihedus võrdeline rõhuga ja pöördvõrdeline absoluutse temperatuuriga. Täpselt kehtib see ideaalgaasi korral, aga mitte kõik gaasid ei allu piisavalt hästi ideaalse gaasi mudelile. Meenutame, et ideaalgaasi mudel on rakendatav hõredatele gaasidele (molekulide mõõtmed on võrreldes molekulidevahelise kaugusega tühised), kus molekulid üksteist ei mõjuta (va omavahelised elastsed põrked).
Reaalsed gaasid võivad seega erineda ideaalgaasi mudelist kahel põhjusel:
A) Rõhk. Molekulaarjõud (ptk Van der Waalsi jõud ja vesinikside) mida ideaalgaasi mudelis ei arvestata, sest molekulid on üksteisest kaugel, hakkavad kõrgemal rõhul ja madalamal temperatuuril siiski mõjuma.
Rõhk anuma seinale koosneb mikrotasandil üksikute molekulide elastsetest põrgetest. Ideaalse gaasi molekulid just nii anuma seinale rõhuvadki. Reaalses gaasis on põrke momendil gaasi molekuli ees anuma sein, aga „selja tagant” mõjutavad teda teised gaasi molekulid. Mida tihedamalt molekule ja mida polaarsemad molekulid, seda suurem on mõju.
B) Ruumala. Ideaalgaasi mudel eeldab, et molekulid on punktmassid, st mõõtmeteta. Sel juhul oleks kogu gaasi ruumala gaasi molekulide liikumiseks vaba. Reaalses gaasis võtavad molekulid ise ka ruumi, mida suuremad molekulid ja mida rohkem molekule ruumalaühikus, seda enam.
Reaalseid gaase kirjeldavad ebatavalistes oludes (kondenseerumistemperatuuri lähedal, väga kõrgel rõhul) mitmed reaalgaasi mudelid, kus klassikalisele gaasi olekuvõrrandile lisanduvad vajalikud täiendused.
Milline gaas on kõige ideaalsem? Ideaalse gaasi mudelile vastab kõige täpsemalt gaas, mille molekul on kõige väiksem, ei ole polaarne ja peaaegu ei polariseeru ka ajutiselt. See on heelium, mille molekul koosneb ühest pisikesest aatomist. Ka vesiniku molekul on väike, aga koosneb kahest aatomist, mis võimaldab õige veidi suuremate molekulaarjõudude teket.
Uurime ühte konkreetset reaalgaasi näidet. Millistel tingimustel ja kuivõrd kaldub lämmastik ideaalgaasi mudelist kõrvale?
Meenutame, et ideaalse gaasi olekuvõrrand seob gaasi koguse (), rõhu (), ruumala () ja temperatuuri () gaasi olekuvõrrandisse. R = 8314 J·K-1·kmol-1 (universaalne gaasikonstant).
ja
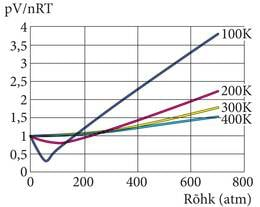
Saadud jagatis on võrdne ühega, kuni gaas käitub vastavalt ideaalgaasi mudelile. Kui uurida reaalse lämmastiku kokkusurumist või paisumist erinevatel temperatuuridel, siis tuleb välja mitu erinevust.
Joonis 1.2.5. ei ole tegelikult tehtud gaaside ruumala, rõhu ja temperatuuri mõõtmise järgi, vaid kajastab üht enamlevinud reaalgaasi kirjeldust, van der Waalsi võrrandit:
Võrreldes ideaalgaasi lihtsa võrrandiga, võime siin märgata „parandusi”. Konstant kirjeldab molekulide vahelisi mõjusid ja molekulide ruumala.
Ideaalgaas
Keemine
Keemine on vedeliku üleminek vedelast faasist gaasilisse, nii et aurustumine ei toimu mitte ainult vedeliku pinnalt, vaid kogu ruumalas tekkivate aurumullidena.
Tahkis ja teised
Tahkiste (tahkete kehade) eripära ilmneb deformeerimisel. Ainult tahkised avaldavad deformeerimisele vastupanu. Vedelike ja tahkiste ühine omadus on säilitada ruumala, mispärast neid nimetatakse kondensaineks.
Gaasid ja vedelikud
Gaasid ja vedelikud erinevad küll kokkusurutavuse poolest, aga tänu kindla kuju puudumisele on mõlemad voolavad, sellest ka nende ühine nimetamine voolisteks.
Ideaalse gaasi mudel reaalsuses
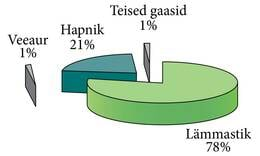
Õhu komponentide mahuline vahekord on üsna püsiv. Kuiv õhk koosneb lämmastikust (78%), hapnikust (21%) ja veel umbes kümnest gaasist (kokku 1%). Selle viimase ühe protsendi hulgas on kõige rohkem argooni (0,93%), aga ka atmosfääri toimimise seisukohalt väga olulist süsinikdioksiidi ja metaani. Selline oleks kuiva atmosfääri koostis, aga meie igapäevane õhk sisaldab peale nimetatu alati veel väikeses koguses veeauru. Veeaur on ainus atmosfääri komponent, mille sisaldus õhus pidevalt muutub. Õhus olev veeauru kogus muutub nii ööpäeva jooksul kui ka aastaaegade lõikes. Muutused on tihedalt seotud temperatuuriga ja omavad suurt tähtsust kliima kujunemisel. Kogu atmosfäärist on mahuliselt umbes 0,4% veeaur. Maapinna lähedal on veeauru õhus tavaliselt 1-4%. Veeauru sisaldust õhus nimetatakse õhuniiskuseks.
Soojal suvepäeval (õhutemperatuur 25°C) võib ühes kuupmeetris õhus olla näiteks 15 g vett. Veeauru sisaldust õhus võib arvuliselt väljendada mitmel moel, massi, ruumala või rõhu kaudu. Kõige lihtsam ongi märkida ühes kuupmeetris õhus sisalduva vee mass. Seda nimetatakse absoluutseks õhuniiskuseks () või veeauru tiheduseks. Grammi kuupmeetri kohta ongi tiheduse ühik, õhu tihedus on näiteks 1,29 kg/m3 ehk 1290 g/m3.
Niisiis, kirjeldataval suvepäeval võib näiteks olla õhu absoluutne niiskus
Samadel tingimustel (õhurõhk ja temperatuur) võib absoluutne niiskus olla väiksem, aga ka veidi suurem, kuid üle 23g/m3 see olla ei saa, kui temperatuur ei tõuse. Kui õhk muutub näiteks veekogudest aurustumise tõttu järjest niiskemaks, siis ühel hetkel tekib küllastunud veeaur. Küllastus tähendab seda, et nii palju, kui molekule läheb üle gaasi faasi, läheb neid ka tagasi vedeliku faasi. Normaalsel atmosfäärirõhul 25°C juures ei saa veeauru tihedus olla suurem kui 23g/m3. Seda nimetatakse küllastunud veeauru tiheduseks (). Kui vesi veekogude pinnalt, vihmapiiskadelt või taimede lehtedelt aurustub, siis absoluutne niiskus kasvab, aga ei ületa tavaliselt küllastatud auru tihedust. See tähendab, et maksimaalne absoluutne niiskus samadel tingimustel on
Küllastumine sõltub temperatuurist, igal õhutemperatuuril on oma küllastunud auru tihedus, mis on laboratoorselt määratud (ptk 1.6.) ja mida võib vaadata vastavast tabelist. Kõrgemal temperatuuril on küllastunud auru tihedused suuremad. Väga kuuma ja märja ilmaga (37°C) võiks ühes kuupmeetris õhus olla isegi 44 g veeauru, aga tihtipeale on kuumad ilmad pigem kuivad ja küllastus saabub hoopis temperatuuri langemise tõttu. Enamasti on õhus veeauru küllastusest vähem, aga välitingimustes võib õhuniiskus küllatuseni tõusta näiteks vihmase ilmaga või veepinnalt aurustumise tulemusena. Kuigi väike vihmasadu ei pruugi küllastuse saabumiseks piisavalt auru lisada, on siiski kindel, kestva saju ja uduga on õhu absoluutne niiskus maksimaalne võimalik.
Õhu veesisaldust kirjeldatakse mõnikord nii, nagu imaks õhk endasse vett või hoiaks kõrgemal temperatuuril tänu soojusliikumisele rohkem veeauru kinni. See pole õige ettekujutus.
On tõepoolest ahvatlevalt lihtne kirjeldada õhuniiskust, eriti küllastumist, nagu hoiaksid õhu gaaside molekulid vee molekule (veeauru) õhus justkui üksteisele palli põrgatades. Kuna kõrgemal temperatuuril on soojusliikumine intensiivsem, siis tundub loogiline, et kiiresti liikuvad lämmastiku ja hapniku molekulid nügivad vee molekule enam, ei lase neil kokku saada ja piiskadeks kondenseeruda. Tegelikult see nii ei ole.
Browni liikumise kirjeldused, eriti arvutimudelid, on meile siin karuteene teinud. Kipume mõtlema, et nii nagu vee molekulid põrgatavad ringi väikseid tahkeid kehakesi, nii ka molekulid poksivad üksteist. Tegelikult on vee molekulid õhu põhiliste koostisosade molekulidest väiksemad ja neid on õhus väga vähe. Ka lämmastikku ja hapnikku on tegelikult üsna vähe, st molekulid on gaasis päris hõredalt ja tühja ruumi jääb palju. Toatemperatuuril on õhu molekulide vahelised keskmised kaugused umbes 10 korda suuremad molekulide mõõtmetest ja keskmine molekuli liikumiskiirus umbes 600 m/s. Kui vaadata mõnda arvutimudelit, kus soojusliikumist visualiseeritakse, siis on molekulid enamasti kujutatud üsna suurelt, nad liiguvad väga aeglaselt ja kohtuvad liiga tihti. Näitlikkuse mõttes on see vajalik, sest 600 m/s liikuva molekuli kujutamine tühise kihutava täpikesena arvutiekraanil ei visualiseeriks midagi.
Küllastunud veeauru tihedus ei sõltu teiste gaaside juuresolekust. Vabalt veepinnalt auraks ka täiesti tühjas ruumis temperatuuril 25°C nii palju vett, et küllastunud auru tihedusoleks ikka 23 g/m3. Kõrgemal temperatuuril rohkem, madalamal vähem. Lämmastiku molekulid ei takista molekulide lahkumist veepinnalt ega ka soosi seda.
Tuleb meenutada, et vesi on teistest õhu gaasidest erinev. Lämmastik ja hapnik on maapealsete temperatuuride juures alati gaasid, aga vesi tuleb ette tahkes, vedelas ja gaasifaasis (ptk 1.1 ja 1.2.). Kui veepinnalt aurustub sama palju molekule, kui sinna tagasi kondenseerub, siis ongi tegemist küllastumisega. Madalal temperatuuril tekib samasugune tasakaal jää ja auru vahel. Lisaks sellele on vee molekulid polaarsed, mõjutavad üksteist teatud määral ja veeaur ei käitu seepärast päris ideaalse gaasina (ptk 1.2.).
Suhteline õhuniiskus. Kui on teada, et õhus on tõesti kuupmeetri kohta 15 g veeauru (), aga nimetatud temperatuuril võiks olla kuni 23 g (A25°C), siis ei ole raske välja arvutada, millise osa (mitu %) võimalikust moodustab tegelik. Seda suhet väljendatakse peaaegu alati protsentides ja nimetatakse suhteliseks (relatiivseks) õhuniiskuseks (). Suhteline õhuniiskus on inimeste tervise ja enesetunde hindamise seisukohalt oluline näitaja. Ka ilmaennustuses on suhteline niiskus parem näitaja kui absoluutne.
Kui juba nimetatud arvud valemisse panna, siis tuleb välja, et meie näidispäeva suhteline õhuniiskus on
Mugav on, kui eluruumides on õhu suhteline niiskus parajalt keskmine. Nii liiga kuiv kui ka liiga niiske õhk on pikema aja jooksule tervisele kahjulikud. Näiteks kooliruumides peab vastavalt tervisekaitsenõuetele õhuniiskus olema 30%–70%. Eluruumides peetakse siiski paremaks hoida niiskus vahemikus 40%–60%. Kahjuks on talvisel ajal köetud ruumides õhuniiskus tihti alla 30%, mis pole tervisele hea.
Tabel Küllastunud õhuniiskus erinevatel temperatuuridel.
Veeaur õhus
Õhu koostises on peaaegu alati väike kogus veeauru. Veeauru mass ühes kuupmeetris õhus on õhu absoluutne niiskus ehk veeauru tihedus.
Selle, kui palju veeauru maksimaalselt õhus võib olla, määrab eelkõige temperatuur. Eelneva peatüki näites oli 25°C õhus 1 m3 kohta 15 g veeauru, mis on 65% küllastusest. Kui seesama õhk jahtub, siis jääb absoluutne niiskus samaks, ikka endiselt 15 g/m3. Aga suhteline niiskus enam sama ei ole, sest madalamal temperatuuril on küllastunud auru tihedus väiksem. Näiteks 20°C juures on küllastunud auru tihedus 17,3 g/m3. Suhteline niiskus on nüüd 86,7%. Ilmselgelt saabub temperatuuri edasisel langemisel olukord, kus küllastus ja tegelik auru tihedus on võrdsed. Suhteline niiskus on siis 100%. Kui temperatuur veelgi langeb, siis tekib olukord, kus õhus peaks olema rohkem veeauru, kui seal antud temperatuuril saab olla. Ei ole midagi parata, osa veeaurust peab kondenseeruma vedelaks veeks. Looduses kohtame me seda olukorda üsna tihti, tegemist on udu ja kastega. Temperatuuri, mille juures veeaur hakkab kondenseeruma, nimetatakse kastepunktiks.
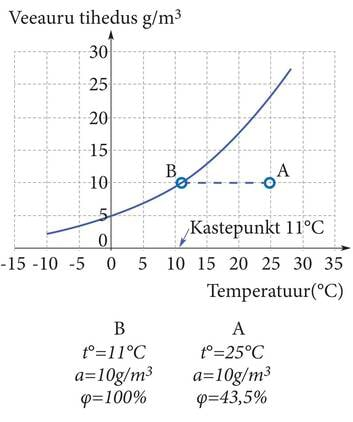
| Joonis 1.4.1 Sinise joonega on tähistatud küllastunud veeauru tiheduse temperatuurist sõltuvuse graafik, st veeauru absoluutse tiheduse väärtused, mis erinevate temperatuuride korral tähendavad suhtelist niiskust 100%. Punktis A on õhutemperatuur 25°C ja absoluutne õhuniiskus on 10 g/m³. Suhteline niiskus on sel juhul 43,5%. Temperatuuri langedes õhu absoluutne niiskus (õhu tegelik veesisaldus) ei muutu, küll aga suureneb suhteline niiskus. Punktis B on temperatuur 11°C, absoluutne õhuniiskus on endiselt 10 g/m³, aga suhteline niiskus on nüüd 100%. Edasisel jahtumisel osa veeaurust kondenseerub või härmatub. Õhu tegelik veeauru sisaldus väheneb seeläbi, aga suhteline jääb ikka 100%. Kui seesama õhk jahtuks näiteks 0°C, oleks 1 m³ veeauru juba alla 5 g, ja suhteline niiskus ikka 100%. Igast kuupmeetrist oleks kondenseerunud üle 5 g vett. | Joonis 1.4.2 Veepiisad külmal pudelil. Külmad kehad jahutavad lähema õhukihi nii palju maha, et kastepunkt saab ületatud ja piisad tekivad jahedale pinnale. Tegemist on sama nähtusega, mis põhjustab kaste langemist rohule ja lehtedele, kui õhutemperatuur maapinnal kastepunktini langeb. Kui mõni keha on väga külm, siis jõuab ta õhku natuke laiemalt jahutada ja võib näha tekkimas väikest udupilve, mis soojas õhus kiiresti hajub, st tekkinud udupiisad aurustuvad uuesti (joonis 1.2.4.). |
Kastepunkti on väga lihtne märgata. Kui suveõhtul paljajalu murul käies tunnete, et varbad saavad märjaks, siis ongi temperatuur maapinnal langenud kastepunktini. Kui õnnestub sel hetkel määrata temperatuur maapinnal, siis see ongi kastepunkt. Kastepunkti kaudu kalibreeritakse tihti õhuniiskuse mõõteriistu, hügromeetreid.
Kui kastepunkt jääb alla 0°C, siis vedelat vett muidugi tekkida ei saa. Ka seda nähtust me tunneme ja armastame. See on härmatumine.
Pilved. Õhuniiskusel on oluline roll pilvede moodustumisel. Väga üldiselt öeldes saavadki pilved moodustuda ainult õhus olevast veeaurust. Pilvede moodustumiseks ja sademete langemiseks on siiski vaja täita mitu tingimust.
A) Õhus peab olema piisavalt veeauru, et kondenseerumine saaks alata (meie kliimas sellest tavaliselt puudust pole).
B) Õhk peab jahtuma alla kastepunkti.
C) Kondenseerumise algamiseks on vaja kondensatsioonituumi. Tuumadeks kõlbavad soolakristallikesed, tolm, tahm, bakterid ja muu õhusaaste. Tuumosakeste puudumisel võib õhk nii palju jahtuda, st suhteline niiskus tõuseb tublisti üle saja protsendi, aga kondenseerumine ei alga.
D) Erinevate pilvede tekke ja sademete seisukohalt on oluline ka jääkristallide teke.
Kui õhk on piisavalt niiske, on pilvede tekkeks vaja jahtumist. See võib toimuda mitmel moel: erinevate õhumasside segunemisel, õhu jahtumisel kiirgumise või aurustumise tõttu, õhu paisumisel. Rünkpilved (mida üldiselt peetakse kõige ilusamaks ja õigemaks pilveliigiks) tekivad tihti just sellest, et niiske õhk tõustes paisub (rõhk langeb) ja seepärast jahtub alla kastepunkti. Seepärast on rünkpilved enamasti altpoolt tasased - sama niiskusega õhumassi tõusmisel saabub kastepunkt ligikaudu samal kõrgusel.
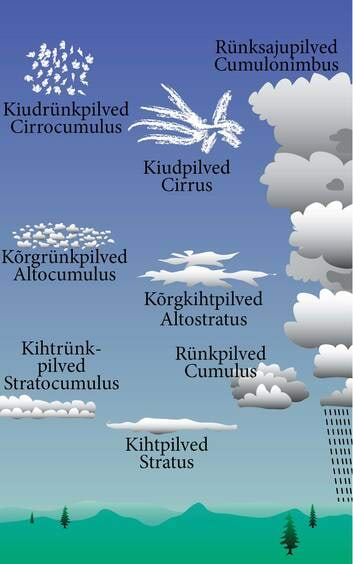
| Joonis 1.4.3 Pilvevaatlemine on meteoroloogias tähtis oskus. Kaasaegne pilvemääraja eristab kümme põhiliiki. Lisaks kirjeldatakse pilvede looduslikku mitmekesisust paljude erikujudena ja pilvevormidena. Tähtis on pilvede moodustumise viis ja kõrgus. Pilved pakuvad huvi ka paljudele harrastusmeteoroloogidele ja ilmatarkadele, sest teatud määral võimaldab pilvetundmine lühiajaliselt ilma ennustada. |
Kõrbelise kliimaga aladel ei saa sajupilved tekkida just õhu kuivuse tõttu. Kui absoluutne niiskus on väga madal, siis ei vii isegi päris korralik jahtumine kastepunktini, pilvi ei teki ja sademeid ei ole. Kohaliku kliima kujunemisel on olulisemad tegurid õhutemperatuur ja -niiskus, aga ka tuuled, õhurõhk jm. Seepärast päris otsest seost õhuniiskuse ja sademete vahel ei ole. Näiteks maailma kõige kuivemaks kohaks peetavas Atacama kõrbes (Lõuna-Ameerika idarannikul) ei saja peaaegu kunagi, ometi on taevas pilves ja õhk võrreldes teiste kõrbetega suhteliselt niiske. Sademeid arvestatakse seal pikaajalise keskmisena umbes 1 mm aastas, paljudel aastatel ei saja üldse. Eestis sajab tavaliselt 520–820 mm aastas. Atacama vihmapuuduse põhjuseks loetakse ümbritsevate mägede ja püsiva hoovuse mõju õhurõhule ja õhumasside liikumisele. Kuigi seal vihma ei saja, võimaldab niiske õhk mõnikord udu ja kaste tekkimist, millest piisab samblike ja isegi mõnede kaktuste eluspüsimiseks.
Tuleb tunnistada, et kuigi pilvede teket on palju uuritud, ei ole tänaseni lõpuni selged biosfääri ühendite, õhureostuse (sh lennukite heitgaaside) ja kosmilise kiirguse seosed pilvetekkega.
Sõna „ilm” on eesti keeles mõnusalt mitmetähenduslik. Ilmatu suur Maailm, kõik see mis meid ümbritseb. Maa ja ilm, all ja üleval. Meil on varnast võtta tõlkimatu käibenali, et ilmast ilma on ilmaga jama, aga ilma ilmata ka läbi ei saa. Oleme harjunud ilmaennustust kiruma ja vähesed on valmis ilmaennustajaid ehk sünoptikuid teadlasteks pidama. Kindlasti hindame me ilmanähtusi väga subjektiivselt. Vaevalt, et keegi vaidlustab vihmasadude vajalikkuse. Samas on tavapärane pahandada, kui vihma sajab puhkuse ajale planeeritud jalgrattamatka kõigil päevadel ja öödel. Muidugi kerkib siis küsimus, miks on ilma nii raske ennustada?
On tõsi, et me elame muutliku ilmaga kohas. Mitmetes kohtades üle maailma esineb üsna regulaarseid ilmanähtusi (sajab põhiliselt õhtuti, vihmaperiood algab septembris, lumi tuleb maha novembri algul ja püsib aprillini), meil see paraku nii lihtne ei ole.
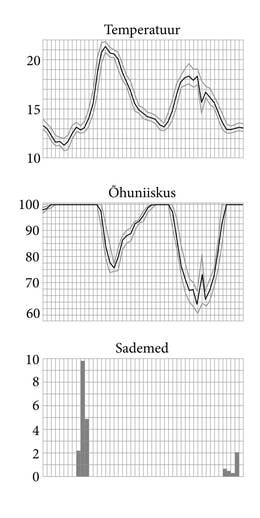
Vaatame kõigepealt, kuidas ilmanäitajad ühes konkreetses kohas ööpäevade lõikes muutuvad (joonis 1.5.1.). Seejuures märkame mitmeid üsna kohapealse iseloomuga muutusi. Päeval on soojem kui öösel, üks päev on soojem, teine pisut jahedam, öösel on õhuniiskus 100%.
Temperatuur. Graafikutele jääb vähemalt osaliselt kolm ööd. Esimese päeva õhutemperatuuri maksimum on kõrgem kui teisel ehk nagu tavaliselt öeldakse, esimene päev oli soojem.
Teise päeva temperatuuri käigus on märgatav jõnks, mille põhjus ei selgu esitatud graafikutelt.
Õhuniiskus. Laias laastus on temperatuuri ja suhtelise õhuniiskuse graafikud vastupidised, st kui on soe, on suhteline niiskus väiksem. Jahedatel öödel tõuseb niiskus 100%-ni, on kastene või udune. Kõige esimene öö on olnud jahedam ja ka õhuniiskuse graafik püsib pikalt 100% peal.
Niiskuse graafik teeb teisel päeval väga täpselt kaasa temperatuuri kõikumised, kõik täpselt tagurpidi. Ka temperatuurigraafikule vastav jõnks on samal kellaajal.
Sademed. Esimesel hommikul, kui temperatuur oli juba tõusnud, ei hakanud õhuniiskuse graafik sugugi langema. Selle põhjuseks oli hommikune vihmasadu. Kui sadu lakkas, sai ka niiskuse graafik „laest lahti”.
Õhtust kastet ja hommikust udu, isegi väikest vihmasabinat saab edukalt seletada kohalike veekogude pinnalt ja taimelehtedelt aurustunud vee kondenseerumisega. Suuremad sajud ja lumetuisud peavad ilmselgelt pärinema mõnelt suuremalt veeauru allikalt, küllap siis ookeanilt.
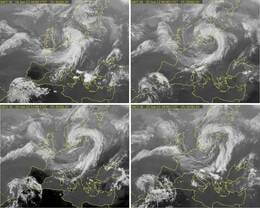
Vaatame ühte konkreetset näidet sellest, kuidas suvised vihmasajud Eestisse jõuavad (joonis 1.5.2.). 24. juunil on olnud üsna ilus, kuigi mitte eriti soe suvepäev. Õhtul on meil vahelduva pilvitusega ilm, mõõdukas tuul puhub kirdest. Tähelepanelik vaatleja võib märgata, et päike loojub pilvedesse. See ei ennusta head ilma, sest väga tihti tulevad meile järgmiseks päevaks just need pilved, mis õhtul edelast paistavad. Vanarahva ilmatarkuski ütleb, et kui loojuv päike tagasi vaatab, tuleb homme ilus päev. Meteoroloogiasatelliitide piltidelt võib näha, et eelmisel päeval Atlandi ookeanil aurustunud veest on moodustunud pilvekeeris, mis liigub üle Kesk-Euroopa ja peaks 25. juunil ületama Eesti. Kindlasti tuleb sajune päev. Pöörlev niiske õhumass ei ole küll ise külm, aga tõmbab tuule suunda muutes meile põhja poolt külmemat õhku ja seepärast on järgmine päev mitte ainult vihmane, vaid ka jahe. Teise päeva õhtuks on sajud taandunud kirdesse, aga satelliidipilt näitab juba uue keerise tekkimist Briti saartest läänes. Esialgu on veel vara öelda, kuhu poole niiske õhumass järgmiseks täpselt pöördub, aga võib-olla juba südaööks saavad sünoptikud ka selle kohta ennustuse tehtud.
Seda piirkonda, mis meie ilma nii oluliselt mõjutab, nimetatakse mõnikord Põhja-Atlandi ilmakatlaks. Selles katlas keedetakse enamasti meie suvised sajud ja sügistormid. Sealse temperatuuri, õhurõhu ja -niiskuse, tuulte jm järgi arvutatakse järgmiste päevade ilmateade. Euroopa ülikoolides ja teadusinstituutides arendatakse ja rakendatakse pidevalt mitmeid ilmamudeleid. Tuleb tunnistada, et tänaseks on kolme päeva ilmateade enamasti palju-palju parem, kui me tahame tunnistada. Ilmaennustajate kirumise traditsioon on visa kaduma. Siiski ei aita ka väga head andmed ja ülivõimsad arvutid teha kuigi täpset ilmaennustust pikemaks ajaks. Näiteks järgmise aasta jaaniõhtut need ilmamudelid planeerida ei aita. Siin Läänemere ääres sõltub igapäevane ilm siiski päris paljudest pisiasjadest ja atmosfäär on nii suur, et piltlikult öeldes „ilm ei tea isegi, milline ta järgmisel suvel tuleb”.
Õnneks on meie ilmad siiski mõõdukad. Ka meid ohustavad tormid ja tuisud, merevee taseme tõus, suured sajud ja üleujutused, rahe ja teisedki äärmuslikud ilmanähtused. Samas oleme mitmestki päris äärmuslikust riskist seni vabad. Atlandi ookeani teisel kaldal tabavad igal aastal Kuubat ja Floridat troopilised orkaanid. On kostnud arvamusi, et kliima muutumine võib viia selleni, et ka meid hakkavad orkaanid kimbutama. Tegelikult seda ohtu siiski pole, kliima peaks selleks ikka väga-väga palju muutuma, et troopilised tsüklonid Läänemerele jõuaksid. Vaikse ookeani idaosa suurtest ilmariskidest kuulsaim kannab nime El Niño. Tegemist on ookeani pinna erakordse soojenemisega, mille tingivad püsivad muutused tuule suunas. El Niño on perioodiline nähtus, aga väga täpset korda ta ei pea, sama olukord tekib uuesti 4 kuni 7 aasta järel. Sooja pinnavee kogunemine Lõuna-Ameerika rannikule põhjustab olulisi ilmamuutusi. Tavaliselt kuiva kliimaga Peruud ja Ecuadori kimbutavad vihmasajud. Austraalias, kus niigi ollakse tihti hädas kuivuse ja kuumaga, esinevad El Niño aastatel erakordsed põuad. Hoovuste muutumine mõjutab kalavarusid ja seekaudu paljude piirkondade majandust. Klimaatilised muutused ulatuvad kaugele Põhja-Ameerika sisemaale, mõnedel hinnangutel on mõju lausa globaalne.
Õhuniiskuse mõõtmiseks kasutatakse hügromeetreid. Muidugi on olemas ka muude niiskuste (näiteks puidu niiskuse) mõõtmise hügromeetrid, aga siin tuleb juttu õhuniiskuse mõõtmise viisidest. Hügromeetrid on kasutusel kasvuhoonetes, tööstusruumides, inkubaatorites, saunades, muuseumides, ladudes jm. Pole paha ka elu-, töö- ja kooliruumides vahel õhuniiskust kontrollida. Niiskuse mõõtmine on peaaegu alati kaudne. Kõige otsesem viis absoluutse niiskuse mõõtmiseks on kaalumine. Kaaluda tuleks uuritav õhk ja võrdne ruumala kuiva õhku. Masside erinevusest on lihtne arvutada veeauru kogus ühes kuupmeetris ehk absoluutne õhuniiskus. Põhimõtteliselt on selline mõõtmine võimalik, aga igapäevaseks tarvitamiseks kohmakas.
Suhtelise niiskuse igapäevaseks määramiseks kasutatakse mitmete materjalide omaduste muutumist sõltuvalt niiskusest. Õhuniiskusega seotud muutusi võime märgata ka oma tavaliste asjade juures. Puit on näiteks materjal, mille niiskus kõigub koos õhu veesisaldusega ja puitesemete mõõtmed muutuvad. Kapiuksed käivad kuiva ilmaga kergemini, mõni sahtel ei tule niiskel sügisel hästi lahti. Muusikud teavad, et puidust pillid lähevad ilmamuutusega häälest ära. Raamatukogude hoidlates jälgitakse hoolega õhuniiskust, sest liiga kuivas õhus tõmbuvad raamatukaaned kõveraks. Laialt on tuntud mitmete elektrinähtuste seos õhuniiskusega. Mitmesugused niiskumisega ja kuivamisega seotud füüsikaliste omaduste muutused annavad võimaluse konstrueerida erinevaid hügromeetreid.
Juushügromeeter. Suur osa elu- ja tööruumide mõõteriistu, mis aitavad meil valvata, et õhk oleks tubades tervislikult niiske, mõõdavad juuksekarva pikkust. Inimese juustel, aga ka muudel loomsetel- ja isegi tehiskiududel on omadus olla niiskes õhus veidi pikem kui kuivas. Vahe ei ole väga suur, aga piisav, et seda muutust üsna lihtsa ülekandega osuti abil nähtavaks muuta.
Elektrilised hügromeetrid. On olemas aineid, mille elektrilised omadused (takistus või dielektriline läbitavus) sõltuvad niiskusest. Neil nähtustel põhinevad hügromeetrid on tänapäeval laialt levinud, sest võimaldavad väga lihtsalt pikaajalise mõõtmise tulemusi salvestada.
Kuigi need laialt kasutatavad hügromeetrid on lihtsad ja odavad, on neid vaja millegi järgi kalibreerida. Selleks on põhiliselt kasutusel kaks veidi keerulisemat hügromeetri tüüpi, kus ei kasutata niiskusega kaasnevaid materjalide omaduste muutusi, vaid õhu aurusisaldusega kaasnevaid füüsikalisi nähtusi.
Psühromeeter. Õhuniiskuse määramise klassikaline, psühromeetriline meetod seob kokku kaks aurustumisega (ptk Gaas ja vedelik) seotud nähtust.
A) Aurustumise intensiivsus on seotud õhuniiskusega. Igaüks teab, et kuivamine (vee aurustumine asjadelt, riietelt, inimestelt) toimub kuiva ilmaga palju kiiremini. 100% õhuniiskuse korral näiteks pesu üldse ei kuiva. Pesukuivatamisel on teisi nähtusi, mis võivad tublisti abiks olla, näiteks päikesepaiste ja tuul. Mõõteriistades püütakse need segavad nähtused kontrolli alla hoida, nii et aurustumist määraks ainult õhuniiskus.
B) Aurustumiseks kulub energiat ja kui kehalt aurustub vett, siis ta jahtub. Näiteks teame, et märgades riietes on külm. Kokku tähendab see, et kuivas õhus peab märg keha jahtuma rohkem kui niiskes õhus, kui kõik muud tingimused on samad.
Psühromeeter koosneb kahest termomeetrist. Üks on kuiv, teine hoitakse pidevalt märg. Lihtne vahend vedeliktermomeetri niisutamiseks on reservuaari ümber keeratud märg lapp, mis tuleb otsapidi vees hoida. Kui õhk on veeaurust küllastunud (õhuniiskus 100%), siis vesi märjalt lapilt ei aurustu, märg termomeeter ei jahtu ja näitab koos kuivaga ümbritseva keskkonna temperatuuri. Kui suhteline niiskus on väiksem, siis hakkab märjalt termomeetrilt vett aurustuma, see jahtub ja temperatuurinäitudesse tekib vahe. Vahe on seda suurem, mida kuivem on õhk. Psühromeetriga käib kaasas vastav tabel, kust saab leida temperatuurierinevusele vastava õhuniiskuse.
Täpseteks meteoroloogiavaatlusteks ja teiste hügromeetrite kalibreerimiseks kasutatavates psühromeetrites luuakse eriti kontrollitud tingimused. Õhu liikumiskiirus termomeetrite ümber hoitakse ventilaatoriga täpselt võrdne ja termomeetrid on eraldi kaitstud igasuguse välise soojuskiirguse eest.
Jahutatud peegel. Hügromeetrite kalibreerimiseks sobib hästi kastepunkt, temperatuur, mille juures õhus olev veeaur hakkab kondenseeruma (ptk Kastepunkt). Väga hästi on kondenseerumise algus (kaste langemine) näha peegelpinnal. Kastepunkti määramiseks mõõdetakse jahutatava peegli temperatuur täpselt kondenseerumise algushetkel. Peegli uduseks muutumise võib määrata hoolsa vaatlemisega, aga on olemas ka elektroonilised meetodid. Kastepunktile vastava absoluutse niiskuse saab vaadata tabelist. Elektrooniliste seadmete korral on tabel muidugi arvutimälus. Sedasorti hügromeetreid kasutatakse tihti laborites, sest kuigi üsna täpsed ja töökindlad, vajavad nad hooldamist ja puhastamist. Tulemusi võivad häirida tolm ja muu õhusaaste.
Vedeliku ja gaasi piirpinna lähemaks uurimiseks vaatleme kõigepealt vihmapiiska. Kui õhk, mis sisaldab piisavalt veeauru ja kondensatsioonituumi, on piisavalt jahtunud (ptk Kastepunkt), tekivad piisad, mis võivad õhuvooludes hõljuda, aga võivad ka sademetena alla langeda. Kuid mis hoiab vihmapiiska koos?
Vastus on lihtne: kõiki vedelikukoguseid hoiavad koos molekulaarjõud. Piiskades toimivad need jõud sarnaste osakeste vahel (näiteks elavhõbedatilgas või vihmapiisas), neid nimetatakse kohesioonijõududeks (ladina keeles: cohaereo - kokku kuuluma, tervikut moodustama).
Kui vihmapiisk jõuab aknale, siis hoiavad teda seal kinni jälle molekulaarjõud. Kuna klaasi ja vihmavee molekulid on erinevad, siis on tegemist adhesioonijõududega (ladina keeles: adhaereo - kinni hoidma, küljes rippuma).
Kohesioon ja adhesioon osalevad mitmetes huvitavates ja olulistes nähtustes: pindpinevus, vedelike voolamine torudes ja lahtistes voolusängides, tilkumine, märgumine, imbumine poorsetesse ja kiulistesse materjalidesse.
Meenutame, et faasidevahelisel (ptk Faasid) piirpinnal on tihti erilisi omadusi, seal toimuvad mitmed füüsikalised ja keemilised protsessid, ilmneb erinevaid nähtusi. Vihmapiisaski on vedeliku ja gaasi piirpinna molekulid täiesti erilises olukorras. Vedeliku sees on iga molekul ühtlaselt ümbritsetud naabritega ja seotud kohesioonijõududega, mis on keskmiselt võttes tasakaalus (resultantjõud on null). Piirpinnal on olukord teine. Väljaspool (gaasi poolel) on molekule väga vähe, tasakaal on rikutud ja seepärast mõjub pinnakihi molekulidele summaarselt tõmme ainult ühes suunas, sissepoole. See tekitab vedeliku pinnakihis teatava pinge, mida nimetatakse pindpinevusjõuks. Pindpinevust võrreldakse tihti põhjendatult venitatud (pingutatud) elastse kilega. Kui täispuhutud õhupalli pigistada, siis kummikile venib suuremaks. Kui pall uuesti lahti lasta, püüdleb ta tagasi minimaalse pindala poole, täpsemalt minimaalse potentsiaalse energia poole. Sarnaselt toimib ka vihmapiisk. Vee ja õhu piirpind on alati võimalikult väike. Muude mõjude puudumisel on vihmapiisk kerakujuline, sest kera on sama ruumala juures kõige väiksema pindalaga keha.
Vedelike pinnakihil on omadus kokku tõmbuda, olla võimalikult väikese pindalaga. Seda nähtust, pindpinevust, kirjeldab pindpinevusjõud. Kui suur on pindpinevusjõud ja millest ta sõltub?
Vaatleme nüüd ühte koolifüüsikas hästi tuntud pindpinevuse katset. Peenikesest traadist rõngas on vee all. Kinnitame rõnga külge tundliku dünamomeetri ja üritame rõngast ettevaatlikult läbi veepinna välja tõsta. Kui rõngas on juba osaliselt veepinnast kõrgemal, siis on dünamomeetrilt näha, et veepind „ei lase rõngast lahti”. Hea nägemise korral võib paljude veest välja tõstetavate esemete korral märgata, kuidas veepind venib teatud määral asjadele järele. Siin ilmutabki pindpinevusjõud end mõõdetaval moel. Puhta vee ja hea katsekorralduse juures on võimalik ära mõõta, et 15,9 cm läbimõõduga rõnga veepinnalt lahtirebimiseks toatemperatuuril on vaja jõudu umbes 73 mN (). Sellise läbimõõduga rõnga korral on katkirebitavat veepinda üks meeter (), pool meetrit rõnga siseküljel ja sama palju välisküljel. Pindpinevusjõud ühikulise pikkuse kohta kannab nime pindpinevustegur. Kui vesi ei ole puhas või on tegemist hoopis mingi teise vedelikuga, siis saame kirjeldatud katses ka teise jõu. Pindpinevustegur on vedelikku iseloomustav suurus, kõigil vedelikel ja lahustel erinev.
Katse kokkuvõttena võime kirjutada:
Vee pindpinevustegur () on 0,073 njuutonit meetri kohta. Pindpinevustegur kirjeldab jõudu ühikulise pikkuse kohta. Samas kirjeldab pindpinevustegur ka energiat ühikulise pinna kohta ja seega on tal võrdväärne ühik: džauli ruutmeetri kohta (J/m2). Seepärast kõneldakse mõnikord pinnaenergiast ja pindpinevuse piltliku seletamise jaoks on see isegi parem. Meenutame, et potentsiaalse energia miinimumi printsiip on üks füüsika üldprintsiipidest ja vastavalt sellele püüdleb ka vedeliku vaba pind minimaalse energia poole, st minimaalse pindala poole.
Tabel Vedelike pindpinevustegurid temperatuuril 20°C
Pindpinevusjõu ja pinnaenergia kohta võime seega öelda:
jaKus on pindpinevustegur, on vedeliku piirpinna pikkus ja on vedeliku pinna pindala.
Pindpinevusteguri määramise näites venis veepind koos rõngaga ülespoole, kui me rõngast veepinnalt tõstsime, aga tegelikult pole selleks vaja midagi tõsta. Samas nõus, kus katset tegime, võib märgata, kuidas vesi päris servas üsna vähesel määral „üritab mööda seina üles voolata”. Nähtust, kus vedelik tahket pinda mööda laiali valgub, nimetatakse märgamiseks. Ei ole raske märgata, et mitte alati ei märga vedelik tahket ainet. Märgumatust ainest anuma ja vedeliku kokkupuutepiiril ei kõverdu vedeliku pinnakiht mitte üles, vaid alla. See, kas vedelik märgab pinda või mitte, sõltub adhesiooni- ja kohesioonijõudude suhtest.
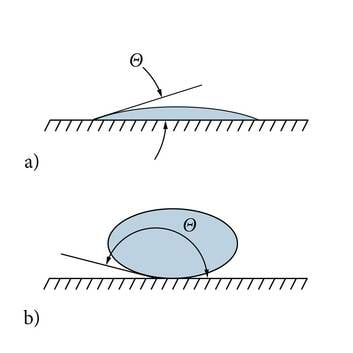
Üsna ilmekas on märgamist jälgida horisontaalsel pinnal lebava väikese vedelikutilga korral. Gaasi ja vedeliku piirpind moodustab tahke alusega nurga (Θ), mida mõõdetakse vedeliku seest ja nimetatakse märgamisnurgaks. Kui vedelik valgub alusel laiali (märgamine), on tilk lame, märgamisnurk on teravnurk. Nii käituvad näiteks kondensaaditilgad külmal pudelil (joonis 1.4.2.). Ideaalse märgamise korral vajuks vedelik alusele täielikult laiali, moodustades ühe molekuli paksuse kihi. Kui piisk võtab alusel pigem kera kuju (mittemärgamine), on märgamisnurk nürinurk. Tihti käituvad nii hommikused kastetilgad. Piisad pudelil ja taimelehel tekivad mõlemad õhu veeaurust, erinev kuju tuleb tahke pinna erinevusest, täpsemalt adhesioonijõudude erinevusest. Päris kerakujulist piiska ei saa isegi ideaalse mittemärgamise korral. Piisad on raskusjõu tõttu siiski veidi lapikud, mida suuremad, seda enam.
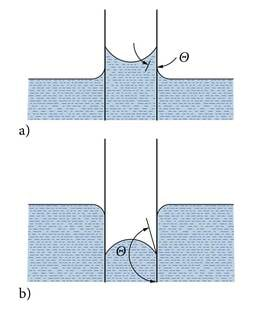
Pindpinevuse ja märgamisega on seotud palju igapäevaseid nähtusi, nagu vee imbumine poorsetesse materjalidesse, vee liikumine pinnases ja taimedes jpm. Vedelike omadust tungida peenikestesse vahedesse, kiudude vahele, pooridesse nimetakse kapillaarsuseks. Vaatleme kapillaarsuse näitena vee käitumist peenikeses püstises klaastorus, kapillaaris. Pole raske märgata, et klaasi ja vee puutepiiril tõuseb vesi veidi mööda klaasi üles. Piisavalt peenikeses vette pistetud torus (joonis 1.7.5.) saavad need veepinna serva kumerdumised keskel kokku. Toru sees tõuseb veepind ümbritsevast veest kõrgemale ja hoiab ligilähedaselt sfäärilist kuju. Vedelikusamba lahtise pinna kõverdunud kuju nimetatakse meniskiks. See tekib kõigis torukestes, pipettides, voolikutes, väikestes mõõtnõudes jm. Paljud inimesed vaatavad värvitud piirituse meniskit oma õuetermomeetri paisumistorus iga päev, aga väiksuse tõttu märgatakse seda harva. Luupi appi võttes on hästi näha sedagi, et elavhõbetermomeetris kõverdub menisk teistpidi, sest elavhõbe klaasi ei märga.
Küsime nüüd, millest sõltub ja kui suur on kapillaartõus? Otsapidi vette pistetud peenikese klaastoru sees tõuseb vesi ümbritsevast veepinnast kõrgemale. Kui kõrgele tõuseb veesammas teatud läbimõõduga klaaskapillaaris?
Kui vesi on kapillaari tõusnud ja püsib seal paigal, siis on tegemist jõudude tasakaaluga. Allapoole suunatud raskusjõud () on tasakaalus pindpinevusjõuga (). Võib öelda, et vee menisk ripub tänu märgamisele servapidi klaasi küljes.
Arvestame, et
ja
Avaldame silindrilises kapillaaris oleva vee massi tiheduse (TeX parse error: Missing superscript or subscript argument) ja vedelikusamba mõõtude (, ) kaudu, vee ja klaasi puutepiiri pikkuse toru läbimõõdu () kaudu ning saame (asendades ja teisendades) kapillaartõusuks:
Kirjeldatud mudel ei ole kuigi täpne. Näiteks arvestasime ülihea märgamisega praktiliselt nullkraadise märgamisnurgaga, mis vee ja klaasi korral muidugi nii ei ole. Ometi annab saadud valem kapillaartõusust hea ettekujutuse. Vedelikud tõusevad kõrgemale peenemates kapillaarides ja suurema pindpinevusteguri korral. Muidugi vähendab kapillaartõusu vedeliku suurem tihedus. Ehitusinsenerid väidavad, et sobivate tingimuste korral võib kapillaartõus näiteks betooni poorides ulatuda kümne kilomeetrini. Kapillaarsusega ja aurustumisega seondub vee ja lahuste liikumine taimedes, pinnases ja ehitusmaterjalides.
Tuletame meelde, et pindpinevust juhivad kohesioonijõud, märgamist aga adhesiooni ja kohesioonijõud koos. Seega on märgamine keeruline ja mitmetahuline nähtus, sõltub nii vedeliku kui tahkise omadustest ja on tundlik vedeliku lisandite ning pinna puhtuse suhtes. Oma osa mängib temperatuur ja aurustumine. Kapillaartõus on küll märgamisega seotud, aga see pole siiski sama nähtus. Hea märgamise korral tõuseb vedelik mööda anuma seina ka laias anumas, mitte ainult kapillaaris. Näiteks õlil ja petrooleumil on omadus mööda nõu seinu „üles ronida” ja nii väliskülg kui lauaplaat mõne päevaga üsna õliseks teha. Samamoodi käituvad alkohol ja kergemad kütused, mis aga aurustumise tõttu lausa pudeli välisküljele ei jõua.
Pindpinevus
Vedeliku ja gaasi piirpinna omadustega seonduvaid nähtusi, mida põhjustab pinnakihi molekulide vaheliste molekulaarjõudude tasakaalustamatus, nimetatakse pindpinevuseks.
Eelmistes peatükkides kirjeldasime pindpinevust ja märgamist kui nähtusi, mis seonduvad vedeliku piirpinna omadustega (gaasiga, tahkisega, teise vedelikuga). Siiamaani käsitlesime neid nähtusi staatilistena. Vihmapiiska kirjeldasime kerakujulisena (ptk Pindpinevus) tekkimise hetkest peale ja ta justkui püsiks sellisena igavesti. Kapillaartõusu mudelis kehtis püsiv tasakaal raskusjõu ja pindpinevusjõu vahel (ptk Kapillaartõus). Tegelikult on võimalus asju nii staatiliselt kirjeldada pigem erand, sest vedelike ja gaaside (vooliste) molekulid on liikumises üsna vabad ja põhiliseks omaduseks on voolamine, sellest nende ühine nimigi. Voolamine on üsna keeruline nähtus, milles osalevad nii voolise osakeste vahelised kohesioonijõud kui ka voolusängi (toru, vooliku, teise vedeliku või gaasi) ja voolava vedeliku vahelised molekulaarjõud . Ka märgumine ja kapillaartõus on dünaamilised nähtused, kus on oma osa vedeliku viskoossusel ja aurustumisel.
Tilkumine. Vaevalt on kuigi paljud inimesed näinud vihmapiisa moodustumist. Esiteks on piisad kõrgel, teiseks on nad algul väga pisikesed. Kuid tilgad tekivad ka tilkumisel, ja tilkuvat kraani on igaüks näinud. Arvatavasti ka kuulnud. Kõige lihtsam ja ilmekam viis tilkade saamiseks ongi lasta vedelikul aeglaselt välja voolata vertikaalse toru alumisest otsast. Kui vedeliku pealevool on piisavalt aeglane, on hästi näha, kuidas veepind hakkab tasapisi allapoole kumerduma. Pealetuleva vedeliku pind venib raskusjõu toimel üha allpoole ja järsku annab miski järele. Tekkinud tilk kukub alla. Kohe hakkab kasvama järgmine. Valmis tilk kukub kahjuks nii kiiresti, et me ei näe täpselt, kuidas ta moodustub, kust ja kuidas veepind järgi annab ja milline on tilga kuju. Kiirkaameraga pildistatult on näha, et eraldunud vedelikukogus võtab kiiresti kera kuju ja pole langedes sugugi „tilgakujuline”. Võib-olla tundub meile, et näeme just sellist tilgakuju hetkel, kui veetilk kraaniavast lahti pääseb. Tuleb tunnistada, et just lahtirebimise hetkel see väga lühikeseks hetkeks nii ongi. Paigalseisvad tilgad (kastepiisad) ja vabalt langevad või hõljuvad tilgad (vihmapiisad) on siiski kerakujulised, kiiremal langemisel natuke langemissuunas lapikuks surutud.
Tilkade mõõtmine pole sugugi keeruline. Tuleb loetud hulk tilku topsikusse koguda ja ära kaaluda. Nii saab arvutada tilga massi ja tilgale mõjuva raskusjõu. Kui vedeliku tihedus on teada, saab arvutada ruumala ja seekaudu ka tilga läbimõõdu.
Tilgutamismeetodil saab määrata vedeliku pindpinevusteguri ja selle kaudu hinnata näiteks lahuste kontsentratsiooni. Kasutades kapillaartõusu juures rakendatud arutluskäiku (ptk 1.7.), on lihtne saada valem pindpinevusteguri arvutamiseks. Tilga lahtirebimise hetkel on allapoole mõjuv raskusjõud ja pindpinevusjõud tasakaalus, mis hoiab tilka toruotsal kinni. Tasakaalutingimus on siis
ja sellest
Piirpinna pikkus, mis lõpuks tilga kasvades enam vastu ei pea, on võrdne toru ümbermõõduga. See ei ole jällegi (sarnaselt kapillaartõusu arvutusele) väga täpne mudel, aga paljudel praktilistel juhtudel päris hästi kasutatav.
Mõnikord on mõistlik pindpinevustegur () arvutada toru läbimõõdu (), vedeliku tiheduse () ja näiteks 100 tilga summaarse ruumala () järgi. See näeks välja nii
ja on üsna hästi kasutatav vedelike (sh segude ja lahuste) kvaliteedi analüüsiks, näiteks kütuste kontrollimiseks.
Mullid. Kondenseerumine ja tilkumine ei ole ainsad viisid tilkade saamiseks. Me kõik tunneme hästi pritsimismeetodit ja tehnikas saadakse vajaliku suuruse ja kontsentratsiooniga piisku pihustamisega. Kuid tilkadel on üks hästituntud analoog, mõnes mõttes ka vastand. Need on mullid, mida me juba nimetasime keemise kirjeldamisel (ptk Gaas ja vedelik). Mulli, nagu tilkagi, piirab gaasi ja vedeliku piirpind. Mullid on tihti kerakujulised nagu tilgadki. Erinevus on selles, et nüüd on piirpind gaasi poolt vaadates nõgus ja vedeliku poolt kumer. Mulli on suletud teatud kogus gaasi ja kuna gaasid on kokkusurutavad, siis on mulli ruumala muutlik. Seoses sellega on mullid tilkadest veelgi dünaamilisemad ja keerukamad uurimisobjektid.
Mullid on väga igapäevane nähtus nii looduses kui tehnikas, võib-olla piiskadest laiemaltki levinud. Lühike ja mitte väga täielik mullitekke nimekiri võiks olla järgmine.
Keemismullid. Keemistemperatuurini kuumutatud vedelikus tekivad aurumullid. Kui aurumull satub konvektsiooni teel kohta, kus temperatuur on keemistemperatuurist madalam, siis aurumull kaob, st kondenseerub uuesti vedelikuks. Intensiivsel kuumutamisel tõusevad keemismullid kiiresti ülespoole ja kasvavad seejuures suuremaks.
Lahustunud gaaside eraldumine, näiteks süsihappegaasi mullide tekkimine karastusjoogi pudeli avamisel.
Õhu segamine vette, näiteks kosest langeva vee või murdlainetuse korral.
Gaasi „puhumine” vedelikku. Näitena võib vaadelda sukelduja väljahingatava õhu pinnaletõusmist või aktiivmuda aereerimist reovee biopuhastis.
Keemilise reaktsiooni gaasilised saadused. Näiteks süsihappegaasi tekkimine söögisooda reageerimisel happega või järvesettest bioloogilisel lagunemisel kerkivad gaasimullid.
Seebimullid. Kindel õhukogus, mis on piiratud õhukese seebiveest kilega, on tuntud seebimullina. Seebivesi ei pea ilmtingimata sisaldama seepi. Kõlbavad ka paljud teised ained, aga tõsi on, et puhtast veest püsivat mulli ei saa. Seebimullide puhumiseks peab pindpinevustegurit vähendama. Seda tehakse pindaktiivsete ainetega. Pindaktiivsete ainete molekuli ehitus on selline, et suur osa neist kogunevad veepinnale, seega ka mullikile pinnale, vähendavad pindpinevustegurit ja veidi ka aurustumist. Mitmesugused pesuained on mullipuhumise juures proovimist väärt.
Tavalised seebimullid ei kesta kaua, enamasti mõned sekundid, harva minuti või rohkem. Lühiealisuse põhjuseks on eelkõige aurustumine ja voolamine. Mullid lihtsalt kuivavad nii õhukeseks, et vedelikukihi sisemine ja välimine külg saavad kokku. Kui õhk on mullist välja pääsenud, püüdleb seebikilet moodustanud vedelik jällegi minimaalse pindala poole, moodustades ideaaljuhul kerakujulise tilga. Tegelikult moodustub küll mitmete kõrvalnähtuste tõttu mitu tilka, aga kerakujulised saavad need igal juhul. Ka raskusjõud on seebimullide vaenlane. Mulli sisemise ja välimise vedelikupinna vahel peab olema piisav seebivee kiht. Kahjuks kipub vesi allapoole voolama, mull jääb ülalt liiga õhukeseks ja lõhkeb. Siiski on võimalik seebivee koostist parandades ja keskkonda niiskena hoides seebimulle säilitada mitmeid päevi, isegi kuid.
Seebikile on ilus füüsikaline analoog matemaatikas tuntud minimaalse pindala probleemile. Kui seebikile mõlemal küljel on sama rõhk, siis kile ei kõverdu. Kui keerata traadist rõngas, kasta see seebivette ja hoida tuuletus õhus, on saadud seebikile täiesti tasane. Mulli korral on aga seebikilesse suletud teatud kogus õhku, rõhk mulli sees on suurem kui väljas ja pind on sfääriline. Juba antiikajast on teada, et kera on sama ruumalaga kujunditest vähima pinnaga, aga selle matemaatilise tõestamiseni jõuti alles 19. sajandil. Matemaatiliselt päris keerukaks osutub pindala küsimus siis, kui mitu mulli kohtuvad. Alles 2000. aastal sai kahe mulli probleem lahenduse, minimaalse pindala reegel kehtib ka sel juhul. Võrdse ruumalaga mullide vaheline seebikile osa on tasase ketta kujuline. Kui mullid ei ole ühesuurused, kumerdub ühine pind suurema mulli poole.
Paljude mullide ühinemisel tekib vaht. Mullide paiknemist vahus kirjeldavad lisaks minimaalse pindala nõudele veel mõned lihtsad reeglid pindade ja nurkade kohta (Plateau seadused).
Siinkohal lõpetame pinnanähtuste teema. Mulliteaduse nüansid ei ole sellega sugugi ammendunud. Kirjeldamata jäid antimullid, omapärane nähtus, kus ühte uurimisobjekti on seotud nii tilga kui ka mulli omadused. Antimulle võib märgata vedelikus hõljuva või pinnal libiseva tilgana, mida eraldab väliskeskkonnast õhuke gaasikiht. Seebimullidele on nad tõesti vastandid. Samuti ei jõudnud rääkida ilma mullideta keemisest. Sellest, kui veetilk kukub kuumale pliidile ja kiiresti ringi kihutades keeb iseendast tekkiva auru padjal ära, ilma et tekiks keemisel iseloomulikku mullide kerkimist. Eraldi kursust vääriksid pinnanähtuste rakendused tehnikas ja tähtsus looduses, sulamine, keemine, tilkumine, mullitamine või vahutamine kaaluta olekus ja palju muud huvitavat.
Nüüd, kui teame juba üsna palju aine erinevatest olekutest ja faaside vahelisest piirpinnast, võib veelkord tagasi tulla faasisiirete juurde, kõigepealt aine agregaatolekute muutumise teemasse.
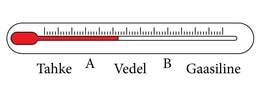
Ühe konkreetse aine olekuid (laiemalt võttes kõiki faase) võib kujutada arvteljel, nagu külili asetatud termomeetril (joonis 1.9.1.). Sellel arvteljel on kaks olulist punkti, A) sulamis- ja tahkumistemperatuur; B) keemis- ja kondensatsioonitemperatuur. Need temperatuurid on aineti erinevad ja seepärast on igal ainel vedela oleku vahemik erineva pikkusega ja erinevas kohas.
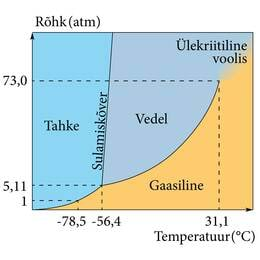
Selline pilt (joonis 1.9.1.) kehtib ainult muutumatu rõhu korral, sest sulamistemperatuur ja eriti keemistemperatuur (joonis 1.2.2.) sõltuvad välisrõhust. Näiteks vee korral on atmosfäärirõhul sulamistemperatuuri ja keemistemperatuuri vahe 100 kraadi. Kõrgemal rõhul on see vahe pikem, madalamal lühem. Et saada täit pilti aine olekute muutustest kõigil rõhkudel, ei piisa ühest arvteljest. Kui aga lisada joonisele 1.9.1. veel sulamise ja keemise andmeid kõrgematel ja madalamatel rõhkudel, saame aine olekute graafilise esituse, mida nimetatakse olekudiagrammiks (joonis 1.9.2.). Olekudiagrammi kõverad kujutavad tingimusi, kus toimub üleminek ühest olekust teise. Tahke ja vedela oleku vahel on sulamiskõver, vedela ja gaasilise piiril on keemiskõver, tahket ja gaasilist olekut eraldab sublimatsioonikõver. Keemiskõveral on keemistemperatuurid erinevatel rõhkudel, sulamiskõveral sulamistemperatuurid erinevatel rõhkudel. Kõverate vahele jäävad alad vastavad tingimustele (rõhk ja temperatuur), mille juures aine on gaasilises, vedelas või tahkes olekus.
Tavaliselt on ainete nii keemis- kui sulamiskõver kaldu kõrgemate temperatuuride poole, aga keemiskõvera kalle on suurem, st et rõhk mõjutab keemist rohkem kui sulamist. Igal diagrammil on üks punkt, kus kõverad kohtuvad. Kuna selles punktis kohtuvad ka aine kolme olekut (gaasilist, vedelat ja tahket) kujutavad diagrammi alad, siis on selle nimi kolmikpunkt.
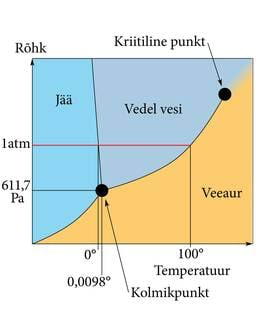
Kui aine temperatuur ja rõhk on faasidiagrammil sulamiskõveral, võib aine korraga olla tahkes ja vedelas olekus, näiteks jääkuubikud vees. Keemiskõverale vastavatel tingimustel esinevad korraga gaas ja vedelik, näiteks aurumullid keevas vedelikus. Kolmikpunkti tingimused võimaldavad ainel olla korraga kolmes olekus. Keevas vedelikus on siis koos nii aurumullid kui ka tahkise tükid. Igapäevaelus me sellist olukorda ei kohta, sest sellised tingimused on üsna haruldased. Igal ainel on ju ainult üks kolmikpunkt. Me elame atmosfääris, mille rõhk on üsna püsiv, umbes üks atmosfäär (1 atm=101325 Pa). Kui me leiaks aine, mille kolmikpunkt on atmosfäärirõhul ja jääb ka elukeskkonna tavalisse temperatuurivahemikku, oleks tõesti võimalik kolme olekut korraga ühes nõus vaadelda. Lihtsate tehniliste vahenditega võib sellise olukorra saavutada veega, meie lemmikainega (joonis 1.9.3.).
Keemiskõveral on veel üks eripära kõrgel temperatuuril ja suure rõhu all. Gaas ja vedelik erinevad tiheduse poolest, vedelike tihedus on suurem. Vedelikud paisuvad kuumutamisel ja nende tihedus väheneb. Teiselt poolt suureneb gaaside tihedus kokkusurumisel. Nii juhtubki, et keemiskõver katkeb ühes punktis, mida nimetatakse kriitiliseks. Sellest punktist edasi pole enam võimalik kokkusurutud gaasil ja paisunud vedelikul kindlat vahet teha. Vastuseta jääb küsimus, kas tegemist on vedeliku tiheduseni kokku surutud gaasiga või gaasisarnaseks paisunud vedelikuga. Ülekriitilises voolises ei saa olla olekutevahelist piirpinda. Pajude tuntud gaaside kriitiline temperatuur on üsna madal. Näiteks metaani (maagaasi) kriitiline punkt on T= 190,7 K (−82,5 °C), p = 46 bar (45,4 atm). Sellest on näha, et igapäevastel temperatuuridel ei saa muuta maagaasi kokkusurumisega pärisvedelikuks. Küll aga saab seda teha jahutamisega.
On üsna loogiline arvata, et ained, mida me gaasideks nimetame, veelduvad madalal temperatuuril ja lõpuks väga-väga madalal temperatuuril tahkuvad. Sellel arvamusel on tõepõhi all, kuid siingi ei saa mööda rõhu küsimusest. Tõepoolest, paljud gaasid veelduvad atmosfäärirõhul, mõned neist väga madalal temperatuuril. Vesiniku keemistemperatuur on 20,28 K (−252,87°C), heeliumil koguni 4,22 K (−268,93°C). Veeldumise mõttes on erandiks ained, mille kolmikpunkt on tavalisest õhurõhust kõrgemal. Sellistest gaasidest ilma rõhku tõstmata vedelikku ei saa. Tahkumise osas jääb erandiks heelium. Ülimadalatel temperatuuridel ilmutab heelium ootamatuid füüsikalisi omadusi (näiteks ülivoolavus) ja tahkeks ta atmosfäärirõhul ei muutugi. Tahke heeliumi saamiseks on vaja rõhku tõsta.
Süsihappegaasi me tunneme igapäevaelus gaasina, tal on isegi vastav nimi. Olekudiagrammi (joonis 1.9.2.) atmosfäärirõhu horisontaali vaadates märkame, et atmosfäärirõhul süsihappegaas ei veeldu (ei kondenseeru vedelikuks), kuitahes osaval jahutamisel. Võib tunduda, et me just seepärast nimetame teda gaasiks, aga päris nii see siiski ei ole. Paljud ained, mida me ikka ja ainult gaasidena tunneme, veelduvad ja tahkuvad üsna sarnaselt veega, st kolmikpunkt on neil allpool atmosfäärirõhku. Näiteks lämmastik veeldub temperatuuril −195,79°C ja tahkub −210°C juures ilma rõhku muutmata.
Kolmikpunktist allpool, st madalmatel rõhkudel ei ole temperatuuri muutmisega võimalik ainet vedelaks muuta. Süsihappegaas (kolmikpunkt T=216,6 K, p=518kPa) on atmosfäärirõhul ainult gaasiline või tahke. Temperatuuril −78,5°C moodustab süsihappegaas härmatise (süsihappelume), mis samal temperatuuril sublimeerub, kui teda soojendada. Soojendamiseks ei ole muidugi vaja muud kui hoidmist toasoojas õhus. Tegelikult on isegi korralik talvepakane tahkunud süsihappegaasile „liiga soe”. Vedelas olekus võib süsihappegaas olla kõrgemal rõhul, nii teda balloonides hoitaksegi. Väljalaskmisel vedelik aurustub ja sellest tuleneva jahtumise tõttu osa tahkub, moodustades süsihappelume, mille pressimisel saadakse nn kuiv jää.
Oleme jälle mitmel korral võtnud näiteks jää, vee ja veeauru. Vee kolmikpunkt on atmosfäärirõhust madalamal, kõik kolm olekut meile hästi tuttavad ja selles mõttes on vesi hea näide. Kuid sellel, niigi erilisel ainel, on ka olekudiagramm ebatavaline. Sulamiskõver ei kaldu rõhu tõustes kõrgemate temperatuuride poole, vaid tavaliste olekudiagrammidega võrreldes nö vales suunas.
Me teame, et vee tahkumisega (jäätumisega) kaasneb ruumala suurenemine, mille tõttu on jää tihedus väiksem kui vedelal veel. Jää ujub vee peal, mis on oluline elu tekke ja kliima stabiilsuse seisukohalt, sest pinnajää kaitseb veekogusid põhjani külmumise eest. Sarnane füüsikaline omadus on tõesti väga vähestel ainetel, peale vee käituvad nii räni, vismut ja veel mõned metallid. Kuid veel on teisigi tavatuid omadusi. Näiteks väga suur erisoojus ja see, et kõrgel rõhul on sulamistemperatuur veidi madalam, mitte kõrgem nagu tavalistel ainetel. Selle eripäraga on püütud seletada jää libedust. Jäätunud tänaval kõndides avaldame me jääle rõhku ja seega on saapataldade all sulamistemperatuur madalam. Võiks arvata, et just seepärast sulab osa jääst veeks ja muudab pinna libedaks. Olekudiagrammi vaadates on ilmne, et see seletus paika ei pea. Sulamiskõvera kalle on liiga väike. Isegi päris suur rõhk vähendab sulamistemperatuuri mõne kraadi võrra, aga jää on libe ka väga külma ilmaga ja üsna väikese rõhu (suured saapad, suusad) korral. Jää libedust on püütud seletada hõõrdumisest tingitud sulamisega, aga seegi hüpotees pole kinnitust leidnud. Tänapäeval peetakse kõige tõenäolisemaks, et jää lihtsalt ongi libe aine. Jääkristallide väga õhuke pinnakiht on pidevalt vedelikusarnases olekus ja see teebki ta libedaks. On omamoodi hämmastav, et 21. sajandi algul on nii igapäevase aine omadused jätkuvalt tõsiseks uurimisteemaks.
Olekudiagrammilt näeme, millistel rõhkudel ja temperatuuridel on sama aine erinevates olekutes. Ainete omadused on erinevates olekutes teistsugused. Gaasid ja vedelikud on voolavad, tahkised mitte. Gaasid on kokkusurutavad, vedelikud ja tahkised mitte. Paljud teisedki omadused on eri olekutes erinevad. Kuid sama aine võib tahkes olekus (ja mõnel juhul ka vedelikuna) ilmutada erinevaid füüsikalisi omadusi ainuüksi aatomite erineva paigutuse tõttu. Sel juhul räägime aine erinevatest faasidest (ptk Faasid). Muidugi on ka olekud erinevad faasid, sest kindlate omadustega ainekogus on teistsugusest ainekogusest piirpinnaga eraldatud. Nagu saime koostada olekudiagrammi tingimuste kohta, mille juures on aine teatud olekus, nii saame ka koostada faasidiagrammi.
Paljude ainete korral toimub üleminek ühest olekust teise kindlal temperatuuril. Sulamise, tahkumise, keemise ja kondenseerumise nähtusi kirjeldasime []sulamise, tahkumise, gaaside ja vedelike peatükkides[]. Samuti võib üleminek (siirdumine) ühest faasist teise toimuda kindlal temperatuuril, mida nimetatakse siirdetemperatuuriks. Seejuures ei pruugi muutuda aine olek, küll aga muutub mingi füüsikaline omadus. Faasisiirete energeetilist efekti kirjeldavad siirdesoojused, nagu näiteks sulamissoojus kirjeldab sulatamiseks kuluvat või tahkumisel eralduvat soojushulka.
Tahkete faaside üleminekul (faasisiirdel) on olekumuutusega võrreldes üks küllalt oluline erinevus. Vaatame näitena süsiniku faasidiagrammi, joonis 1.9.6. Sulamis-, keemis- ja sublimatsioonikõver on üsna sarnased sellega, mida nägime olekudiagrammil (joonis 1.9.2.). Tahke oleku kohale on märgitud grafiit ja lisaks väga kõrgel, ülisuurte rõhkude piirkonnas on kirjas teemant. Teemandid on täiesti olemas atmosfäärirõhul ja toatemperatuuril, aga faasidiagramm näitab tavatingimustes ainult grafiiti. Siin ilmnebki tahkete faaside eripära. Nimelt „elavad” mõned faasid päris edukalt võõrastes tingimustes. Süsinik ei muutu kuidagi iseenesest teemandiks, aga kui see on kord juba juhtunud kõrge rõhu toimel, säilitab teemant oma piirpinna ja füüsikalised omadused uskumatu visadusega.
Süsinik käitub ühest faasist teise üleminekul eriliselt, säilitab oma faasi (st piirpinna ja füüsikalised omadused) kaugel väljaspool faasidiagrammis „talle eraldatud ala”. Mitte kõik faasid ei ole nii visad püsima. Näiteks on hästi tuntud tina millel on kaks tahket faasi, α- ja β- tina. Hõbevalge läikega metalliline β-tina muutub madalal temperatuuril halliks pulbriliseks α-tinaks. Tina faasisiire valgest tinast halliks on autokatalüütiline (kord juba alanud üleminek areneb üha kiirenevalt) ja on võimeline teisi esemeid „nakatama”. Sellepärast nimetatakse nähtust tinakatkuks.Tina saab kuumutamisel oma metallilised omadused tagasi, aga tinast valmistatud esemed on nende üleminekute käigus pöördumatult kadunud.
Tinakatku kohta räägitakse uskumatuid lugusid, mille tõepära üle vaieldakse tänaseni. Napoleoni sõdurid olevat kaotanud külmas Vene talves mundrite tinanööbid ja nagu teada, lõppes sõjakäik lüüasaamisega. Polaaruurijatega juhtunud äparduste nimekirjas on tinaga joodetud toidu- ja kütusenõude lagunemised. Kõige rohkem on kirjutatud Robert Falcon Scotti juhitud retkest lõunapoolusele, kus väga külmades tingimustes olevat lagunenud tinaga joodetud kütuse- ja toidunõud. Katk kahjustab kergesti puhast tina, paljud tinasulamid (isegi väikese lisandiga) on üsna külmakindlad. Tänapäevased mürgiste metallide (plii, kaadmiumi, antimoni) kasutuspiirangud on puhta tinaga jootmise uuesti ausse tõstnud, kuid see võib tekitata probleeme külma käes töötavas elektroonikas.
Tehisteemantide saamise plaani pidasid teadlased juba 18. sajandi algul, kohe pärast seda, kui sai selgeks, et teemant on lihtaine, puhas süsinik. Muidugi oli kaugem lootus valmistada briljantide lihvimiseks sobivaid suuri kive. Teemandi eriline kõvadus pakkus samas tehnilist huvi ja praktilist kasutust leiavad ka pisemad tükid, isegi teemandipuru kulub ära. Looduslikud leiukohad annavad aimu sellest, et kõrge rõhk ja temperatuur on teemantide tekkimisel olulised olnud. Nii proovitigi grafiiti mitmesugusel viisil kuumutamise, pressimise ja jahutamisega teemandiks muuta. Mitmed katsed kuulutati õnnestunuks, aga korduskatsed äpardusid alati. Praegused teadmised aine ehitusest panevad meid uskuma, et varasemates katsetustes saadi küll huvitavaid kristalle, aga teemandid need siiski ei olnud. Esimeste tehisteemantide valmistamiseni jõuti alles 20. sajandi keskel. See on küll selgelt tagantjärele tarkus, aga faasidiagrammi vaadates on nüüd ilmne, et kui lihtsalt väga suure rõhuga teemandid ei teki, siis võiks oodatud tulemuseni „hiilida” läbi vedela või gaasilise oleku. Tegelikult osutus teemantide tootmine tehniliselt palju keerulisemaks, seostudes näiteks süsiniku lahustumisega vedelates metallides. Tänaseks on mitu oleku muutusega seotud tehnoloogiat osutunud edukaks. Tehnilise teemandipuru tootmine on isegi nii odav, et igaüks võib mõõduka hinna eest osta ehituspoest teemantsae või teemantpuuride komplekti.