Tihti kasutatakse vestluses sõnu soe ja külm. Kumb on soojem, kas soe talv või külm suvi? Ütlus „kraanivesi on kuum” tähendab, et vesi on soojem kui seda katsuv käsi. Täpsemate väidete korral kasutatakse mõistet temperatuur, mille määramiseks on juba väga ammu valmistatud mõõteriistu – mitmesuguseid termomeetreid. Termomeeter mõõdab soojuspaisumist, termoelektromotoorjõu tekkimist, infrapunakiirgust või muud temperatuurist sõltuvat suurust. Arusaam temperatuuri olemusest tekkis aga hiljem, 19. sajandil koos teadmiste avardumisega ainete siseehitusest.
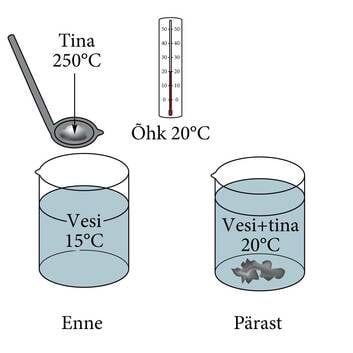
Oletame, et õnnevalamisel kallasime külma vette teatava koguse sulatina (joonis 1.23.). Vee temperatuur tõusis kiiresti ja sai võrdseks toatemperatuuriga ning edasi mingeid muutusi enam ei toimunud. Kuum keha (tina) andis teatud hulga soojust külmale kehale (veele). Tina temperatuur alanes ja vee temperatuur tõusis seni, kuni nende temperatuurid võrdsustusid. Kuna nende ühine temperatuur osutus võrdseks toatemperatuuriga, siis edasisi muutusi ei toimunud ja süsteem jäi tasakaalu. Soojus läheb iseenesest üle soojemalt kehalt külmemale, kuni nende temperatuurid võrdsustuvad. Selline olek vastab soojuslikule tasakaalule. Keha temperatuur iseloomustab soojusliku tasakaalu olekut. Tal on ühesugune väärtus soojuslikus tasakaalus oleva süsteemi kõikides osades.
Temperatuur oleneb keha koostisosakeste energiast – siseenergiast.
Euroopas kasutatakse temperatuuri mõõtmisel ühikuna Celsiuse kraadi. Temperatuurile vastab jää sulamine ja -le vee keemine normaalrõhul.
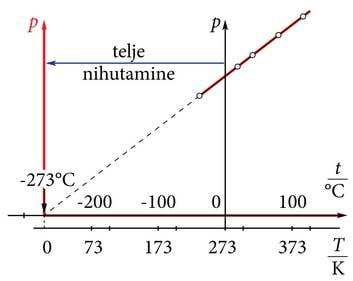
17. ja 18. sajandi vahetusel uuris prantsuse füüsik Guillaume Amonton gaasi rõhu sõltuvust temperatuurist jääval ruumalal (joonis 1.24. a). Ta leidis, et temperatuuri vähenedes kahanes rõhk lineaarselt. Mingil temperatuuril, , peaks gaasi rõhk muutuma nulliks. Seda temperatuuri alumist piiri nimetatakse absoluutseks nulliks. Inglise füüsik lord Kelvin võttis kasutusele nn absoluutse temperatuuriskaala FLA. Selle skaala nullpunktiks on absoluutne null ja ühik (üks kelvin) on võrdne Celsiuse skaala ühikuga. Temperatuur Kelvini skaalas on alati positiivne ja Celsiuse temperatuurist võrra suurem.
Rõhu telje nihutamisel absoluutsesse nulli saame lineaarsest sõltuvusest võrdelise. Jääval ruumalal on gaasi rõhk võrdeline absoluutse temperatuuriga.
Reaalset looduses esineva gaasi lihtsamaks uurimiseks ja mõistmiseks kasutatakse ideaalse gaasi mudelit. Ideaalse gaasi puhul ei arvestata molekulide mõõtmeid ja nendevahelist vastastikmõju. Selle tingimuse ligikaudseks täitmiseks peaks gaas olema piisavalt hõre ja mitte liiga madalal temperatuuril. Ideaalseks gaasiks võib näiteks lugeda kuiva õhku tavalisel temperatuuril ja rõhul.
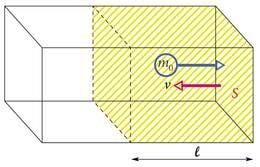
Olgu suletud anumas (joonis 1.25.) ideaalne gaas, mille molekulid liiguvad kaootiliselt ja põrkuvad elastselt anuma seintega. Mõtteliselt eraldatud osas ruumalaga on molekuli igaüks massiga . Anuma seinale pindalaga lähenevate molekulide keskmine kiirus on .
Proovime hinnata molekulide põrgetest tulenevat anuma seinale avaldatavat rõhku. Seinaga jõuavad aja jooksul põrkuda pooled molekulidest, mis ei asu kaugemal kui
Mehaanikast on teada (M), et impulsi muut elastsel põrkel on . Kehale mõjuv jõud (M) on võrdne impulsi muutumise kiirusega.
ja ühe molekuli poolt seinale avaldatav jõud on
Kogu seinale mõjuva jõu saame, korrutades selle põrgete arvuga . Seinale avaldatav jõud
Arvestades, et molekulide kontsentratsioon
saame rõhuks
Arutluses eeldasime, nagu liiguksid molekulid ühes sihis. Tegelikult pole kaootilise liikumise korral ükski suund eelistatud ja täpsema tuletuskäigu korral saame:
Valem annab ideaalse gaasi rõhu sõltuvuse mikroparameetritest: kontsentratsioonist, molekuli massist ja kiirusest. Rõhk kui makroparameeter on mõõdetav näiteks baromeetri või manomeetriga.
Kui võtame kasutusele mõiste molekulide keskmine kineetiline energia
saame:
Ideaalse gaasi rõhk on võrdeline molekulide kaootilise liikumise keskmise kineetilise energiaga.
Eelmises õppetükis saime teada, et gaasi rõhk oli ka võrdeline absoluutse temperatuuriga. Kokkuvõtvalt saab järeldada, et ideaalse gaasi molekulide keskmine kineetiline energia on võrdeline gaasi absoluutse temperatuuriga:
kus suurust nimetatakse Boltzmanni konstandiks.
Valemis 4.17 esinev suurus v2 on molekulide kiiruste ruutude keskmine väärtus. Ruutjuur sellest on ruutkeskmine kiirus:
Ideaalne gaas
Ideaalne gaas on selline gaas, mille molekulide mõõtmeid pole vaja arvestada ja mille molekulide vastastikmõju on tühine.
Gaasiga toimuvate protsesside käigus võivad muutuda selle rõhk, ruumala ja temperatuur – olekuparameetrid. Näitame, et ideaalse gaasi olekuparameetrid on omavahel seotud nn ideaalse gaasi olekuvõrrandiga.
Valemitest 1.17, 1.18 ja 1.19 saame rõhu jaoks:
Molekulide arvu saame avaldada ainehulga ja Avogadro arvu järgi:
kus on gaasi mass ja molaarmass. Asendades ja avaldades, saame rõhu ja ruumala korrutiseks:
Suurust nimetatakse gaasikonstandiks ja seega:
Ideaalse gaasi rõhu ja ruumala korrutis on võrdeline tema absoluutse temperatuuriga. Kui me vaatleme antud gaasikogust kahes erinevas olekus, saame olekuvõrrandi teise kuju:
Antud gaasikoguse rõhu ja ruumala korrutis jagatud absoluutse temperatuuriga on jääv suurus. Viimase valemi kontrolliks on vaja määrata gaasi ruumala, mõõta manomeetriga rõhk ning termomeetriga temperatuur (joonis 1.26.). Valemi 1.21. kontrollimiseks peab määrama gaasi massi ja teadma molaarmassi (piisab ka ainehulgast).
Gaaside omadused sõltuvad temperatuurist ja õhurõhust. Seetõttu on võetud kasutusele mõiste normaaltingimused: temperatuur ja rõhk . Ühe mooli gaasi ruumala normaaltingimustel on 22,4 liitrit.
Isoprotsessi käigus ei muutu üks olekuparameetritest ja vastav parameeter taandub gaasi olekuvõrrandist välja.
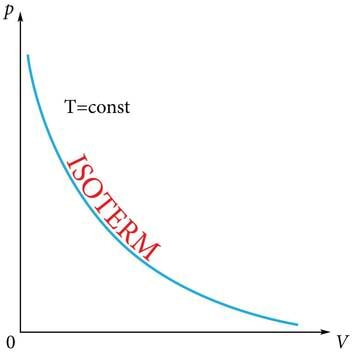
Isotermilise protsessi käigus ei muutu temperatuur. Saame ideaalse gaasi jaoks võrrandi:
millest järgnev valem annab pöördvõrdelise sõltuvuse rõhu ja ruumala vahel (joonis 1.27. a).
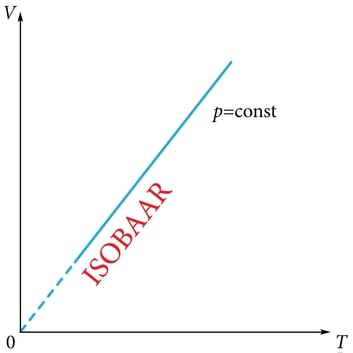
Isobaarilise protsessi käigus ei muutu rõhk. Saame gaasi jaoks võrrandi:
millest järgnev valem väljendab ruumala võrdelist sõltuvust absoluutsest temperatuurist (joonis 1.27. b).
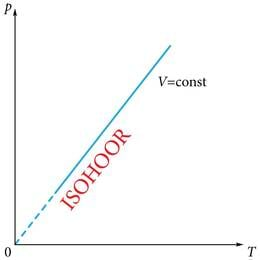
Isohoorilise protsessi käigus ei muutu ruumala. Saame võrrandi:
millest järgnev valem väljendab ideaalse gaasi rõhu võrdelist sõltuvust absoluutsest temperatuurist (joonis 1.27. c).
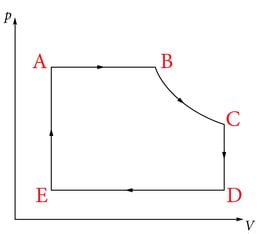
Joonisel on kujutatud erinevatest isoprotsessidest koosnev lõpuks samasse olekusse tagasi jõudev ringprotsess -teljestikus. on isobaariline paisumine, isotermiline paisumine, isobaariline kokkusurumine ning isohooriline protsess lõpetab ringprotsessi ühe tsükli.
Kõik ained koosnevad osakestest, mis liiguvad kaootiliselt ja mõjutavad üksteist. Järelikult omavad kehade koostisosad nii kineetilist kui ka potentsiaalset energiat. Keha siseenergiaks nimetatakse tema kõikide koostisosakeste kineetiliste ja potentsiaalsete energiate summat. Seda energiat vaadeldakse kehaga seotud taustsüsteemi suhtes.
Vastastikmõju potentsiaalset energiat on raske arvutada. Seepärast toome näite ideaalsest gaasist, mis koosneb ühesugustest üksikuna esinevatest aatomitest, ehk üheaatomilisest ideaalsest gaasist. Ideaalse gaasi molekulid ei mõjuta üksteist (potentsiaalne energia on ) ja sellise gaasi siseenergia on kõikide molekulide kineetiliste energiate summa. Siseenergia leidmiseks tuleb molekuli keskmine kineetiline energia korrutada molekulide (antud juhul aatomite) arvuga.
Üheaatomilise ideaalse gaasi siseenergia on võrdeline absoluutse temperatuuriga. Kui ideaalse gaasi molekulis on rohkem aatomeid, siis võrdelisus absoluutse temperatuuriga jääb kehtima, aga võrdetegur on erinev. Näiteks kaheaatomilise gaasi korral on see 3/2 asemel . Siseenergia on suurem seetõttu, et kaheaatomilise gaasi puhul lisanduvad võnkumise ja pöörlemise energiad.
Siseenergia sõltub ainult keha või kehade süsteemi siseolekust. Siseenergia hõlmab kõigi süsteemi osakeste, näiteks molekulide, aatomite, ioonide ja vabade elektronide liikumise, kineetilise ning vastastikmõju potentsiaalse energia, samuti nende sisestruktuuriga seoses oleva elektronkatte, tuuma jne energia. Rakenduste korral on oluline siseenergia muut, seetõttu jäetakse tavaliselt arvestamata need komponendid, mis uuritavas protsessis ei muutu. Soojusliku tasakaalu olekus on siseenergial kindel väärtus, siseenergia on olekufunktsioon. Siseenergia seob omavahel makro- ja mikrosuurused ning soojusõpetuse mehaanikaga.
Kui keha on soojusvahetuses teiste kehadega soojusjuhtivuse, konvektsiooni ja soojuskiirguse kaudu, nimetatakse saadud või ära antud siseenergiat soojushulgaks.
Soojushulk on siseenergia hulk, mille keha saab või annab ära soojusülekandel.
Jalgrattakummi pumpamisel kokkusurutud õhk ja pump soojenevad. Kuum gaas teeb mootoris paisudes tööd siseenergia vähenemise arvelt ja jahtub. Keha siseenergia muutmiseks on kaks võimalust – soojushulga saamine või äraandmine ja mehaaniline töö. Järgnevatel fotodel on raudlati temperatuuri ja siseenergia suurendamine soojushulga saamisega koldes ning lati töötlemisel ketaslõikuriga.